题目内容
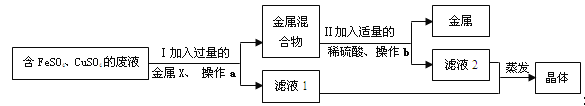
【题目】甲乙丙三个实验小组分别进行“Na2CO3和NaOH混合物中Na2CO3含量测定”的实验:
(1)甲组的实验方案是:将50克的混合物溶解在水中配成溶液,滴加10%稀盐酸,观察到现象: 。根据消耗盐酸溶液的质量来测定碳酸钠的含量。你认为这个方案是否正确,理由是_______ 。
(2)乙组同学的方案是:根据沉淀的质量计算得出碳酸钠的含量,
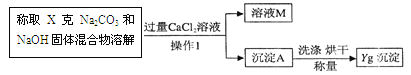
乙经正确计算,得出碳酸钠的含量偏大,原因可能是 ,溶液M中的溶质(用化学式表示)是 。
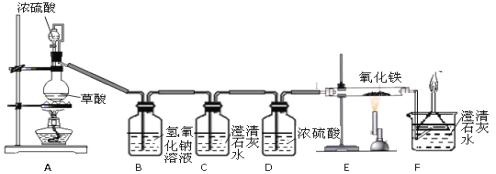
(3)丙组的实验方案是:将50克样品与足量的稀盐酸反应,用下图装置测定产生的CO2气体的体积,通过计算得出样品中Na2CO3的质量。请分析装置中油层的作用是____ _ ____。现收集到0.1摩尔CO2气体,求原混合物中Na2CO3的质量百分数是多少?(精确到0.1%)。(根据化学方程式,写出计算过程)
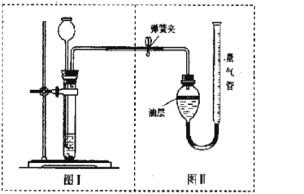
【答案】(1)(1)过一会儿产生气泡 (1分)、正确,因为碳酸钠和氢氧化钠都会消耗盐酸 (1分)(2)洗涤不充分或没有完全干燥(1分), (1分)氯化钙、(1分)氯化钠和(1分)氢氧化钠(3)防止二氧化碳溶解在水中或和水反应 ; 21.2%
【解析】
试题分析:(1)(1)甲组的实验方案是:将50克的混合物溶解在水中配成溶液,滴加10%稀盐酸,观察到现象是过一会儿产生气泡 该方案是正确,理由是碳酸钠和氢氧化钠都会消耗盐酸 ;(2)乙组同学的方案是:根据沉淀的质量计算得出碳酸钠的含量乙经正确计算,得出碳酸钠的含量偏大,是因为在操作过程中溶质偏多或溶剂偏少引起的,故原因可能是洗涤不充分或没有完全干燥;溶液M中的溶质由过量的氯化钙、生成的氯化钠和没有参加反应的氢氧化钠;(3)(3)丙组的实验方案是,装置中油层的作用是防止二氧化碳溶解在水中或和水反应
设碳酸钠的物质的量为Xmol
![]() (1分)
(1分)
1 1 (1分)
Xmol 0.1mol
![]()
![]() (1分)
(1分)
![]()
![]()

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】(7分)我校实验室有一瓶保管不当的试剂,其残缺的标签中只剩下“钠”和“10%”字样(如图所示)。已知它是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:

【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是下列三类物质中的 (填序号)。
A、酸 B、碱 C、盐
【查阅资料】 Ⅰ、初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ、测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 21.5 | 9.6 |
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 。
【做出猜想】①可能是NaOH溶液;②可能是 溶液;③可能是NaCl溶液。
【设计并实验】 (1)小强取样品少量,滴加无色酚酞试液,液体变红色他认为猜想①正确,他的判断是否合理 ,原因是 。
(2)小华为了检验该溶液到底是什么又进行了如下实验:取样品于试管中,滴加氯化钡溶液,有白色沉淀生成,他得出猜想②正确。相应的化学方程式 。
【题目】“家”是一个化学小世界,蕴含丰富的化学知识。
① 碳酸饮料中常加入防腐剂——苯甲酸(C6H5COOH)。该防腐剂由 (1) 种元素组成,属于 (2) (填“有机物”或“无机物”)。其中碳、氧元素的原子个数比为 (3) 。
② 生石灰是种食品干燥剂,其化学式为 (4) ;热的纯碱溶液可洗涤油污,纯碱的化学式为 (5) 。
③ 下表为几种家用清洁剂的功能及有效成分:
名 称 | 洁厕灵 | 活氧彩漂 | 漂白精 |
功 能 | 有效清除污垢与异味 | 漂洗使衣物色彩鲜艳 | 快速漂除衣物污渍 |
有效成分 | HCl | H2O2 | NaClO |
Ⅰ.不宜用“洁厕灵”清洗大理石地面的原因是(用化学方程式表示) (6) 。
Ⅱ.欲测定“洁厕灵”的酸碱度,可选用 (7) (填字母选项)。
A.pH试纸 B.酚酞溶液 C.石蕊溶液
Ⅲ.向“活氧彩漂”液体中加入少量二氧化锰后产生大量气泡,写出该反应的化学方程式 (8) 。
Ⅳ.“洁厕灵”与“漂白精”不能混用,二者混合易产生一种有毒气体X。反应
原理为:NaClO + 2HCl ![]() NaCl + X↑ + H2O ,则X的化学式为 (9) 。
NaCl + X↑ + H2O ,则X的化学式为 (9) 。