题目内容
【题目】(10分)下图A、B、C是实验室制备某些常见气体的发生装置示意图。
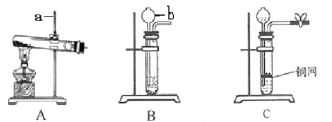
(1)写出图中标号仪器的名称:
a , b 。
(2)A可用作实验室制取氧气的化学方程式是 。
(3)B可用作实验室制取二氧化碳的化学方程式是 。
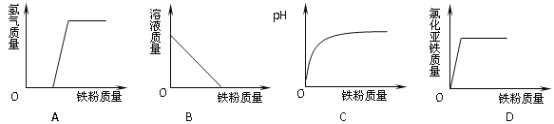
(4)下列装置可用来进行“排空气法”收集H2的是 (填序号)。
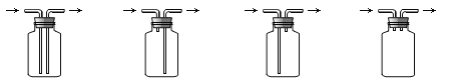
A. B. C. D.
(5)某同学在装置B的基础上,增加了隔离铜网和止水夹等改成装置C来制取二氧化碳,装置C与B相比,突出优点是 。
(6)取石灰石与稀盐酸充分反应后的溶液A, 向其逐滴加入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下(pH为纵坐标,时间为横坐标)。
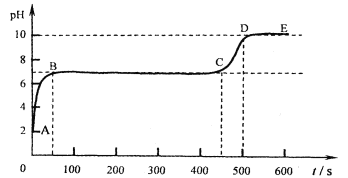
①写出BC段相关的化学方程式是 。
②CD段上升的原因是 。
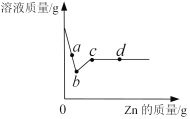
③小红取溶液A50 g,逐滴加入某质量分数的碳酸钠溶液。他根据实验测得的数据绘出下图,其中纵坐标m是实验得到的沉淀的质量,横坐标表示的是碳酸钠溶液质量。由图像回答下列问题:
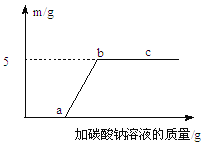
(Ⅰ)原废液中含氯化钙的质量为 g。
(Ⅱ)C点时的溶液中溶质含 。(填化学式)
【答案】(1)铁架台 长颈漏斗
(2)2KMnO4 △K2MnO4+MnO2+O2↑ (3)CaCO3+2HCl = CaCl2+CO2↑+H2O (4)B
(5)能够控制反应的发生和停止 (6)①Na2CO3+CaCl2 = CaCO3↓+2NaCl
②碳酸钠溶液呈碱性,过量的碳酸钠使溶液的碱性增强
③(Ⅰ)5.55 (Ⅱ)NaCl, Na2CO3
【解析】
试题分析:(1) 常见仪器的识记
(2) 气体发生装置的选择依据:反应物的状态和反应条件,采用装置A来作实验室制取氧气,说明是加热高锰酸钾,故化学方程式:2KMnO4 △K2MnO4+MnO2+O2↑
(3) 实验室制取二氧化碳是用大理石和稀盐酸反应,化学方程式是:CaCO3+2HCl =CaCl2+CO2↑+H2O
(4)由于氢气的密度比空气密度小,所以采用短管进,长管出,选B
(5)在装置B的基础上,增加了隔离铜网和止水夹等改成装置C来制取二氧化碳,这样就可以实现固液分离,所以装置C与B相比,突出优点是能够控制反应的发生和停止
(6)取石灰石与稀盐酸充分反应后的溶液A, 向其逐滴加入碳酸钠溶液,根据PH的起始点,可以判断石灰石与稀盐酸充分反应后,盐酸过量,所以溶液A中的溶质有:HCl、CaCl2,故在混合溶液中加入碳酸钠溶液,先发生反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,待盐酸反应完全后,接着发生反应:CaCl2+Na2CO3==CaCO3↓+2NaCl,所以①BC段相关的化学方程式是:CaCl2+Na2CO3==CaCO3↓+2NaCl,②CD段上升的原因是碳酸钠溶液呈碱性,过量的碳酸钠使溶液的碱性增强,
③根据图像,可知生成碳酸钙沉淀质量为5g,根据方程式CaCl2+Na2CO3==CaCO3↓+2NaCl中CaCO3与CaCl2的质量关系,即可求出CaCl2的质量
解:设CaCl2的质量为x
CaCl2+Na2CO3==CaCO3↓+2NaCl
100
X 5g
111:100=X:5g
X=5.55g
(Ⅱ)C点表示的是Na2CO3过量,所以此时的溶液中溶质含NaCl, Na2CO3

 阶梯计算系列答案
阶梯计算系列答案