题目内容
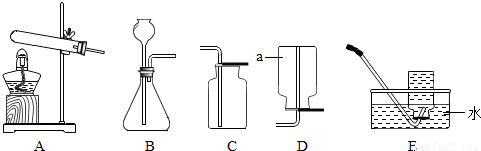
(1)结合如图回答制取及验证气体性质实验的有关问题.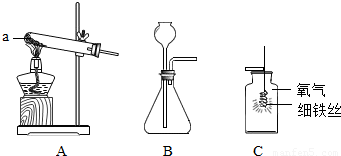
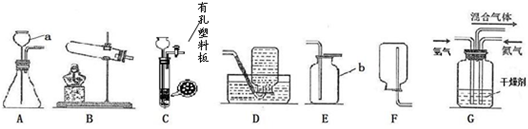
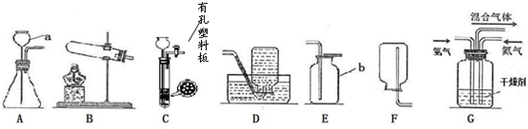
①仪器a的名称是 .
②在初中可同时用来制取O2、CO2和H2的发生装置是 (填字母)
③用稀盐酸和CaCO3制取二氧化碳的反应方程式为 .
④完成图C所示实验时,为避免集气瓶底炸裂,可预先在集气并在集气瓶中放 .
(2)小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的.他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属话动性顺序中的相对位置关系,提出了以下猜想,并进行了实验探究.
[作出猜想]
猜想1.Cr>Al>Cu; 猜想2.Al>Cr>Cu; 猜想3.Al>Cu>Cr.
[查阅资料]
①铬(Cr)是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
③铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液
[实验过程]取大小相同的三种金属薄片,用砂纸打磨光亮.
| 实验一 | 实验二 | 实验三 | |
| 实验 方案 | 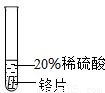 | 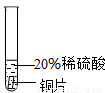 | 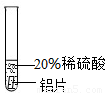 |
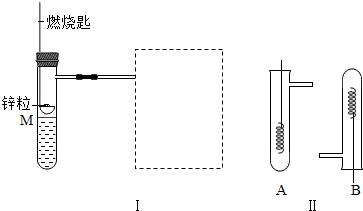
| 实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | . | 铝片表面产生气泡较快 |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | |
| 三种金属在金属活动性顺序中的相对位置关系是 . | |||
①用砂纸打磨金属片的目的是 .
②实验一,发生反应的化学方程式是 .
③小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是 .
④小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是 .
【答案】分析:根据已有的知识进行分析,气体制取装置的选择取决于反应物的状态和反应的条件,收集装置的选择取决于气体的密度和水溶性;在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此解答即可.
解答:解:(1)①据图可知该仪器是酒精灯,故填:酒精灯;
②实验室可以使用过氧化氢溶液和二氧化锰的混合物制取氧气,可以使用石灰石与稀盐酸反应制取二氧化碳,可以使用锌与稀硫酸反应制取氢气,这三个反应都是固液常温型反应,可以使用B装置制取,故填:B;
③碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
④铁丝在氧气中燃烧时会放出大量的热,生成的高温熔融物溅落会炸裂瓶底,需要在瓶底放少量的水或细沙,故填:水或细沙;
(2)铜在氢的后面,铜不能与稀硫酸反应,故无现象,铝表面产生气泡速率较快,说明铝能与稀硫酸反应且活动性较强,通过实验现象的比较可以看出,铝是最活泼的金属,铜是活动性最弱的金属,故其活动性顺序为Al>Cr>Cu,故填:
【回答问题】①用砂纸打磨金属片的目的是除去金属表面氧化物(或污物),故填:除去金属表面氧化物(或污物);
②铬能与稀硫酸反应生成硫酸铬和氢气,故填:Cr+H2SO4=CrSO4+H2↑;
③如果使用硫酸铜溶液,可以证明铬和铝在铜的前面,但是不能证明铬和铝的活动性强弱,故填:无法比较铬和铝的金属活动性强弱;
④使用Al、CrSO4溶液、Cu可以比较这三种金属的活动性顺序,故填:Al、CrSO4溶液、Cu.
点评:本题考查了气体的实验室制取发生和收集装置的选择,以及金属活动性顺序的应用,完成此题,可以依据反应物的状态以及气体的密度和溶解性以及金属活动性顺序的意义进行.
解答:解:(1)①据图可知该仪器是酒精灯,故填:酒精灯;
②实验室可以使用过氧化氢溶液和二氧化锰的混合物制取氧气,可以使用石灰石与稀盐酸反应制取二氧化碳,可以使用锌与稀硫酸反应制取氢气,这三个反应都是固液常温型反应,可以使用B装置制取,故填:B;
③碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
④铁丝在氧气中燃烧时会放出大量的热,生成的高温熔融物溅落会炸裂瓶底,需要在瓶底放少量的水或细沙,故填:水或细沙;
(2)铜在氢的后面,铜不能与稀硫酸反应,故无现象,铝表面产生气泡速率较快,说明铝能与稀硫酸反应且活动性较强,通过实验现象的比较可以看出,铝是最活泼的金属,铜是活动性最弱的金属,故其活动性顺序为Al>Cr>Cu,故填:
| 实验一 | 实验二 | 实验三 | |
| 实验 方案 | 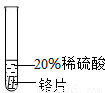 | 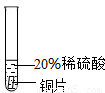 | 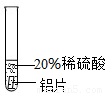 |
| 实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | 无现象. | 铝片表面产生气泡较快 |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是 Al>Cr>Cu. | |||
②铬能与稀硫酸反应生成硫酸铬和氢气,故填:Cr+H2SO4=CrSO4+H2↑;
③如果使用硫酸铜溶液,可以证明铬和铝在铜的前面,但是不能证明铬和铝的活动性强弱,故填:无法比较铬和铝的金属活动性强弱;
④使用Al、CrSO4溶液、Cu可以比较这三种金属的活动性顺序,故填:Al、CrSO4溶液、Cu.
点评:本题考查了气体的实验室制取发生和收集装置的选择,以及金属活动性顺序的应用,完成此题,可以依据反应物的状态以及气体的密度和溶解性以及金属活动性顺序的意义进行.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
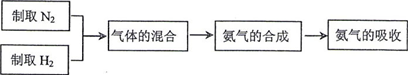



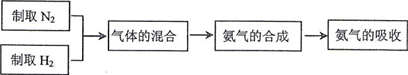
 NH3) 实验室模拟合成氨气的流程如下:
NH3) 实验室模拟合成氨气的流程如下: