题目内容
酒精灯里的燃料是乙醇,化学式为C2H6O,试计算:
(1)乙醇的相对分子质量为 ;
(2)乙醇中各元素原子个数比为 ,各元素的质量比为 ;
(3)乙醇中碳元素的质量分数为多少?(写出计算过程)
(1)乙醇的相对分子质量为
(2)乙醇中各元素原子个数比为
(3)乙醇中碳元素的质量分数为多少?(写出计算过程)
考点:相对分子质量的概念及其计算,元素质量比的计算,元素的质量分数计算
专题:化学式的计算
分析:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数=
×100%,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数=
| 相对原子质量×原子个数 |
| 相对分子质量 |
解答:解:(1)乙醇的相对分子质量为:12×2+1×5+16×5=46.
(2)一个乙醇分子是由2个碳原子、6个氢原子和1个氧原子构成的,故乙醇中各元素原子个数比为C:H:O=2:6:1.
乙醇中碳、氢、氧元素的质量比为(12×2):(1×6):(16×1)=12:3:8.
(3)乙醇中碳元素的质量分数为
×100%≈52.2%.
答案:(1)46
(2)C:H:O=2:6:1; C:H:O=24:6:16(或12:3:8)
(3)52.2%
(2)一个乙醇分子是由2个碳原子、6个氢原子和1个氧原子构成的,故乙醇中各元素原子个数比为C:H:O=2:6:1.
乙醇中碳、氢、氧元素的质量比为(12×2):(1×6):(16×1)=12:3:8.
(3)乙醇中碳元素的质量分数为
| 12×2 |
| 46 |
答案:(1)46
(2)C:H:O=2:6:1; C:H:O=24:6:16(或12:3:8)
(3)52.2%
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
下列关于氧气的用途的叙述中,错误的是( )
| A、氧气可做氧化剂 |
| B、氧炔焰可用来焊接或切割金属 |
| C、氧气可用做燃料 |
| D、氧气制成液氧炸药,可用来开山采矿 |
图中盛装块状烧碱的集气瓶还可以盛装下列哪些物质得到的结果一样( )
| A、石灰石 | B、生石灰 |
| C、孰石灰 | D、石灰水 |
下列实验方案不可行的是( )
| A、用灼烧的方法区别腈纶制品和羊毛制品 |
| B、用点燃的方法除去CO2中混有的少量CO |
| C、用高温灼烧氧化铁和木炭粉混合物的方法制取少量铁 |
| D、用加水溶解的方法区别NaOH、Na2SO4、NH4NO3三种白色固体 |
下列化学式书写规范的是( )
| A、氧化镁mgO |
| B、氯化铝alCl |
| C、氧化铁FeO |
| D、烧碱NaOH |
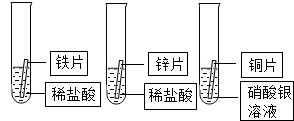
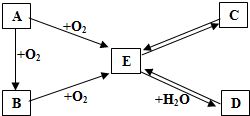 A、B、C、D、E是初中化学中常见的不同物质,其中A为黑色固体单质,C为难溶性钙盐.其转化关系如图所示:
A、B、C、D、E是初中化学中常见的不同物质,其中A为黑色固体单质,C为难溶性钙盐.其转化关系如图所示: