题目内容
根据下图回答问题
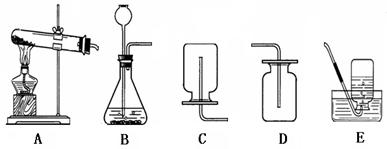
(1)实验室常用稀盐酸和石灰石制取二氧化碳,该反应的化学方程式为 。应选用的发生装置是(填字母,下同) 。 检验二氧化碳是否收集满的方法是 。
(2)实验室常用加热氯酸钾和二氧化锰混合物的方法制取氧气,该反应的化学方程式
为 ;实验室常用金属锌和稀硫酸反应制取氢气,该反应的化学方程式为 ; 收集H2的装置是 。

(1)实验室常用稀盐酸和石灰石制取二氧化碳,该反应的化学方程式为 。应选用的发生装置是(填字母,下同) 。 检验二氧化碳是否收集满的方法是 。
(2)实验室常用加热氯酸钾和二氧化锰混合物的方法制取氧气,该反应的化学方程式
为 ;实验室常用金属锌和稀硫酸反应制取氢气,该反应的化学方程式为 ; 收集H2的装置是 。
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;B;用燃着的木条放在集气瓶口,观察木条是否熄灭
(2)2KClO3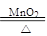 2KCl + 3O2↑;Zn+ H2SO4(稀)= ZnSO4 + H2↑;C(或E)
2KCl + 3O2↑;Zn+ H2SO4(稀)= ZnSO4 + H2↑;C(或E)
(2)2KClO3
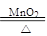 2KCl + 3O2↑;Zn+ H2SO4(稀)= ZnSO4 + H2↑;C(或E)
2KCl + 3O2↑;Zn+ H2SO4(稀)= ZnSO4 + H2↑;C(或E)试题分析:(1)实验室用稀盐酸和石灰石反应制取二氧化碳,同时生成水和氯化钙,故反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;由于是石灰石(固体)和稀盐酸(液体)在常温下反应制得的,故属于“固液不加热型”,故应选择B装置来制取二氧化碳;由于二氧化碳不可燃,也不支持燃烧,故可用燃着的木条放在集气瓶口来验满,如果木条熄灭,说明已集满。
(2)氯酸钾在加热和二氧化锰作催化剂的条件下分解生成氯化钾和氧气,故反应的化学方程式为2KClO3
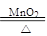 2KCl + 3O2↑;金属锌粒和稀硫酸反应,生成硫酸锌和氢气,故该反应的化学方程式为Zn+ H2SO4= ZnSO4 + H2↑;常用气体的收集装置的选取的依据是气体的溶解性、密度及其是否与水或者空气的成分发生反应等;由于氢气难溶于水,并且不与水发生反应,所以可选取排水法E的装置来收集,同时由于氢气的密度比空气小,并且不与空气的成分发生反应,还可以选取向下排空气法C的装置来收集。
2KCl + 3O2↑;金属锌粒和稀硫酸反应,生成硫酸锌和氢气,故该反应的化学方程式为Zn+ H2SO4= ZnSO4 + H2↑;常用气体的收集装置的选取的依据是气体的溶解性、密度及其是否与水或者空气的成分发生反应等;由于氢气难溶于水,并且不与水发生反应,所以可选取排水法E的装置来收集,同时由于氢气的密度比空气小,并且不与空气的成分发生反应,还可以选取向下排空气法C的装置来收集。点评:本题的重点是常用气体的发生装置和收集装置的选取方法,要学会根据反应物的状态和反应的条件选择发生装置,根据制取气体的溶解性和密度的大小选择收集气体的方法。

练习册系列答案
相关题目