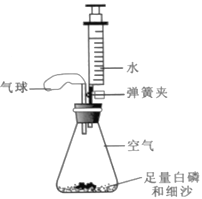
题目内容
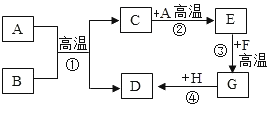
【题目】木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方法如下:
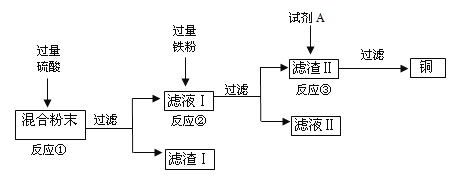
(1)试剂A的名称是______,反应③的化学方程式是______。
(2)过滤是混合物分离的常用方法,过滤后滤液仍然浑浊的可能原因是______,其中玻璃棒的作用是______,上述反应①②③中不属于置换反应的是______。
(3)加入过量的硫酸目的是______。
【答案】稀盐酸(或稀硫酸溶液) Fe+2HCl=FeCl+H↑(或Fe+CuSO=FeSO+Cu) 滤纸破损(或仪器不干净、滤液高于滤纸边缘等) 引流 ① 使氧化铜完全反应
【解析】
在铜、氧化铜、少量木炭粉混合物中加入稀硫酸,稀硫酸只和氧化铜反应,故反应①为稀硫酸和氧化铜反应生成硫酸铜和水,过滤后滤渣Ⅰ为铜单质和少量木炭粉,滤液为硫酸铜溶液;反应②为铁单质和硫酸铜反应生成硫酸亚铁和铜,由于铁粉过量,过滤后滤液Ⅱ为硫酸亚铁,滤渣Ⅱ为铁和铜;反应③为将铜单质中的杂质铁除去,除去铁可以用稀盐酸或稀硫酸(不可以用硫酸铜等,因为生成的铜附着在铁的表面导致无法彻底反应,导致得到的铜不纯),所以试剂A的名称是稀盐酸或稀硫酸,过滤后得到铜单质。
(1)根据分析可知试剂A的名称是稀盐酸或稀硫酸,(不可以用硫酸铜等,因为生成的铜附着在铁的表面导致无法彻底反应,导致得到的铜不纯),反应③的化学方程式是 Fe+2HCl=FeCl+H↑或者Fe+H2SO4=FeSO4+H2↑。
(2)过滤后滤液仍然浑浊的原因可能是滤纸破损(或仪器不干净、滤液高于滤纸边缘等),玻璃棒的作用是引流,反应①CuO+H2SO4=CuSO4+H2O,为复分解反应;②Fe+CuSO4=FeSO4+Cu,为置换反应;③是Fe+2HCl=FeCl+H↑或者Fe+H2SO4=FeSO4+H2↑,为置换反应。所以①不属于置换反应。
(3)加入过量的硫酸目的是让氧化铜完全反应。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案