题目内容
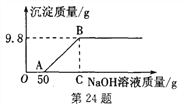
【题目】现有硫酸和硫酸铜的混合溶液200 g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示。
(1) Cu(OH)2的相对分子质量是__________。
(2)生成最大沉淀量时所加入的氢氧化钠溶液的总质量为________。
【答案】 98 130 g
【解析】分析:由关系图,向混合溶液中滴加氢氧化钠溶液先与硫酸反应,待混合溶液中硫酸完全反应后开始与硫酸铜溶液发生反应,因此在计算生成最大沉淀量时所加入的氢氧化钠溶液的总质量时,应该考虑到上述的反应情况,即所加入的氢氧化钠溶液的总质量为与硫酸反应的溶液和与硫酸铜反应的溶液质量和.
解:(1)Cu(OH)2的相对分子质量=64+(16+1)×2=98
故答案为:98;
(2)设与CuSO4反应消耗的氢氧化钠溶液质量为x,则
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
10%x 9.8g
![]()
x=80g
氢氧化钠溶液的总质量=50g+80g=130g
答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为130g.

练习册系列答案
相关题目