题目内容
【题目】控制化学反应的条件可以促进或控制化学反应,更好地使化学反应为人类造福。
(1) 下图是科学家正在研究的二氧化碳循环利用技术:
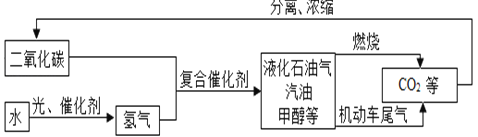
①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式__________________,甲醇中碳元素的化合价为________________。
②从图中分析得出的下列结论中,正确的是__________。(填字母)
A.该技术符合低碳经济的理念 B.水生成氢气的过程中所用的催化剂一定是二氧化碳
C.该技术有助于缓解全球面临的经济危机
D.液化石油气、汽油、甲醇均由碳、氢、氧三种元素组成
(2) 汽油燃烧时氧气的浓度越大,燃烧越剧烈,试从微观角度解释:________________。
(3) 尿素[CO(NH2)2]对提高粮食产量具有重要的作用。人们控制条件可以使CO2和物质M发生反应:CO2+2M===CO(NH2)2+H2O,物质M的化学式为_______________。
【答案】 2CO2+5H2![]() 2CH3OH+H2O_ -2 AC 氧气浓度越大,单位体积内氧分子的数目就越多,汽油分子和氧分子碰撞的几率就越大,燃烧越剧烈 NH3
2CH3OH+H2O_ -2 AC 氧气浓度越大,单位体积内氧分子的数目就越多,汽油分子和氧分子碰撞的几率就越大,燃烧越剧烈 NH3
【解析】本题在新的情境下考查了质量守恒定律的运用。
①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,根据质量守恒定律可知,液态化合物为水,其反应的化学方程式为:2CO2+5H2![]() 2CH3OH+H2O;设:甲醇中碳元素的化合价为X,根据化合物中元素的化合价的代数和为零,则有X+(+1)×4+(-2)=0,X=-2;
2CH3OH+H2O;设:甲醇中碳元素的化合价为X,根据化合物中元素的化合价的代数和为零,则有X+(+1)×4+(-2)=0,X=-2;
②A、二氧化碳循环利用,符合低碳经济的理念,正确;
B、水生成氢气的过程中所用的催化剂不一定是二氧化碳,错误;
C、二氧化碳循环利用,该技术有助于缓解全球面临的能源危机,正确;
D、液化石油气和汽油主要含碳、氢元素,不含氧元素,错误。故选AC 。
(2) 氧气浓度越大,单位体积内氧分子的数目就越多,汽油分子和氧分子碰撞的几率就越大,燃烧越剧烈;
(3) 根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前C、O原子个数是1、2;反应后C、O、N、H原子个数是1、2、2、6,物质M的化学式为NH3。