题目内容
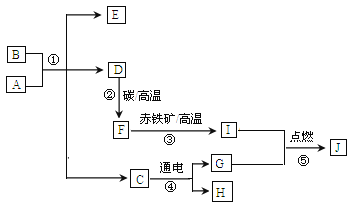
【题目】如图所示,A、B、C、D、E、F 均是初中化学常见物质。A 与 B 发生的是 复分解反应,B 与 C 发生的是中和反应,F 是人体正常生理活动必不可少的一种盐。 结合图中信息,回答有关问题:
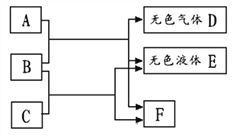
(1)E 的化学式为_____; F 的化学式为_____
(2)若无色气体 D 是一种能使澄清石灰水变浑浊的气体,则 B 与 C 反应的化学方程式为______________;
(3)若无色气体 D 是一种有刺激性气味且能使红色石蕊试纸变蓝色的气体,则C的化学式为_____, A 与 B 反应的化学方程式为_____;
【答案】 H2O NaCl NaOH+HCl=NaCl+H2O HCl NaOH+NH4Cl=NaCl+H2O+NH3↑
【解析】本题是框图型推断题。在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。本题中的特征物质是F,F是人体正常生理活动必不可少的一种盐。
F是人体正常生理活动必不可少的一种盐,F是氯化钠,B与C发生的是中和反应, B和C是盐酸和氢氧化钠中的一种,无色液体E是水,A与B发生的是复分解反应,且会生成氯化钠、水和无色气体D,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠与氯化铵反应生成氯化钠、水和氨气,B可能是盐酸(或氢氧化钠),C是氢氧化钠(或盐酸),A可能是碳酸钠(或氯化铵),D可能是二氧化碳(或氨气),代入框图,推测合理。因此:
(1)E是水,化学式为H2O; F是氯化钠,化学式为NaCl;
(2)若无色气体D是一种能使澄清石灰水变浑浊的气体,D是二氧化碳,则 B 与 C 反应是氢氧化钠与盐酸反应生成氯化钠和水,化学方程式为NaOH + HCl=NaCl+H2O;
(3)若无色气体D是一种有刺激性气味且能使红色石蕊试纸变蓝色的气体,D是氨气,则C是盐酸,化学式为HCl,A与B的反应是氢氧化钠与氯化铵反应生成氯化钠、水和氨气,化学方程式为NaOH+NH4Cl=NaCl+H2O+NH3↑。

【题目】小明在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是他和他的同学一起对这瓶氢氧化钠固体展开探究,请你与他们一起进行探究。
【提出问题】这瓶氢氧化钠固体是否变质?
【猜想与假设】:①该氢氧化钠没有变质;②该氢氧化钠部分变质;③该氢氧化钠全部变质。
【查阅资料】CaCl2溶液呈中性。
【设计实验】取该氢氧化钠固体样品溶于水配成溶液A,进行如下实验:
实验步骤 | 实验现象 | 结论及解释 |
(1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | ___________ | 猜想①不成立 |
(2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | ____________ | 反应的化学方程式为: ______________ |
(3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液。 | 溶液呈红色 | 猜想 ________ 成立 |
【反思与交流】
(4)久置的氢氧化钠变质的原因是(用化学方程式表示) ___________________ 。
【探索与拓展】为进一步探究氢氧化钠的变质程度,小明称取18.6 g氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸100 g,反应后称得烧杯中溶液的质量为114.2 g。
(5)求该样品中碳酸钠的质量(要写出计算过程)。____________。
(6)该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数)为______ 。