题目内容
【题目】用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下。请回答下列问题:
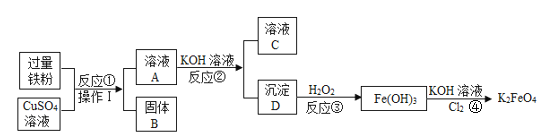
(1)固体B的成分是___________,溶液C一定含有的溶质是_____________。
(2) 实验室中进行操作I时,用到的玻璃仪器除玻璃棒、烧杯外,还需_____________。
(3)反应③中沉淀D与H2O2发生化合反应,反应的化学方程式为____________________________。
(4)反应④一般控制在低温30℃左右进行,这与K2FeO4的物理性质有关,猜测K2FeO4的物理性质是__________。
【答案】铜和铁 硫酸钾 漏斗 2Fe(OH)2+H2O2===2Fe(OH)3 溶解度随温度升高而增大
【解析】
流程过量的铁粉与硫酸铜反应后生成硫酸亚铁和铜单质,因为铁过量,铁没有完全反应,因此固体B中除了有铜之外还有过量的铁;溶液A中主要是硫酸亚铁,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁沉淀和氯酸钾溶液;氢氧化亚铁沉淀被过氧化氢溶液氧化成氢氧化铁,氢氧化铁在氢氧化钾和氯气的共同作用下反应生成了K2FeO4。
(1)由分析得,固体B的成分是铜和铁,由于反应②加入的氢氧化钾的量不确定,因此不知道是硫酸亚铁过量还是氢氧化钾过量,但是两种物质的产物,一定存在溶液中,因此溶液C一定含有的溶质是硫酸钾。故填:铜和铁;硫酸钾
(2)由流程图可知,实验室中操作I是过滤,过滤用到的玻璃仪器除玻璃棒、烧杯外,还需漏斗。故填:漏斗
(3)由分析得,反应③中沉淀D氢氧化亚铁与H2O2发生化合反应生成了氢氧化铁,其反应的化学方程式为:2Fe(OH)2+H2O2===2Fe(OH)3。故填:2Fe(OH)2+H2O2===2Fe(OH)3
(4)K2FeO4的溶解度随着温度的升高而增大,为了减少K2FeO4的溶解,所以④一般控制在低温30℃左右进行。故填:溶解度随温度升高而增大

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案