题目内容
(2013?南通一模)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用氢氧化钠溶液喷淋“捕捉”空气中的CO2(如图).
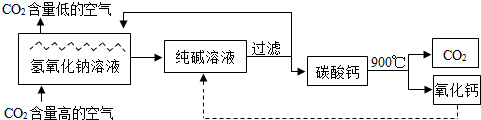
根据上述转化关系,回答下列有关问题:
(1)图中标出的物质中,属于碱类物质的化学式是
(2)碳酸钙发生反应的化学方程式是
(3)将CaO加入到纯碱溶液中,其中发生复分解反应的化学方程式是
(4)若要确认经“捕捉”后的空气中CO2含量已经变低,先分别取一瓶正常的空气样品和一瓶经“捕捉”CO2后的空气样品,然后的实验操作是

根据上述转化关系,回答下列有关问题:
(1)图中标出的物质中,属于碱类物质的化学式是
NaOH
NaOH
.(2)碳酸钙发生反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
.
| ||
(3)将CaO加入到纯碱溶液中,其中发生复分解反应的化学方程式是
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.(4)若要确认经“捕捉”后的空气中CO2含量已经变低,先分别取一瓶正常的空气样品和一瓶经“捕捉”CO2后的空气样品,然后的实验操作是
向其中滴入相同滴数的澄清石灰水
向其中滴入相同滴数的澄清石灰水
.分析:(1)根据碱是指电离时产生的阴离子全是氢氧根离子的化合物分析.
(2)根据碳酸钙高温煅烧生成氧化钙和水分析.
(3)根据氧化钙先和水反应生成氢氧化钙,氢氧化钙和碳酸钠发生复分解反应生成碳酸钙沉淀和氢氧化钠分析.
(4)根据二氧化碳能使澄清石灰水变浑浊分析.
(2)根据碳酸钙高温煅烧生成氧化钙和水分析.
(3)根据氧化钙先和水反应生成氢氧化钙,氢氧化钙和碳酸钠发生复分解反应生成碳酸钙沉淀和氢氧化钠分析.
(4)根据二氧化碳能使澄清石灰水变浑浊分析.
解答:解:(1)碱是指电离时产生的阴离子全是氢氧根离子的化合物,该过程中牵扯到的只有NaOH电离时产生的阴离子全是氢氧根离子,故答案:氢氧化钠.
(2)碳酸钙高温煅烧生成氧化钙和水,故答案:CaCO3
CaO+CO2↑
(3)该过程中氧化钙先和水反应生成氢氧化钙但该反应属化合反应,生成的氢氧化钙再和碳酸钠反应生成碳酸钙和氢氧化钠属复分解反应,故答案:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)二氧化碳能使澄清石灰水变浑浊,故答案:向其中滴入相同滴数的澄清石灰水.
(2)碳酸钙高温煅烧生成氧化钙和水,故答案:CaCO3
| ||
(3)该过程中氧化钙先和水反应生成氢氧化钙但该反应属化合反应,生成的氢氧化钙再和碳酸钠反应生成碳酸钙和氢氧化钠属复分解反应,故答案:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)二氧化碳能使澄清石灰水变浑浊,故答案:向其中滴入相同滴数的澄清石灰水.
点评:二氧化碳的捕捉与封存是热点问题,要分析清楚捕捉和封存过程中的具体反应和原理才能正确解答,熟练系统应用化学知识才能解答.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目

