题目内容
(2012?栖霞区二模)金属是现代生活和工业生产中应用极为普遍的一类材料.

(1)图(1)A是金属的一个应用实例,利用了金属的
图(1)B是两块金属片相互刻划后,在纯铜片上有明显的划痕.该实验探究的目的是
(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀
盐酸里的反应现象如右图(2)所示.
①图(3)中Y所代表的金属是
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
④将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,好像有一层膜兜着.由此可知氧化铝的熔点
(3)用一铝制易拉罐收集满一罐CO2气体,加入适量氢氧化钠溶液,封上口,振荡,会发现易拉罐先变瘪,过一段时间后又重新鼓起.
①易拉罐变瘪的原因是(用化学方程式表示)
②易拉罐为什么又重新鼓起呢?原来铝是一种特殊的金属,能和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质.已知:在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低.则铝和氢氧化钠溶液反应生成的气体单质是
(4)图(4)是工业炼铁的基本生产流程示意图.请回答下列问题:
①写出设备A 的名称:
②写出以赤铁矿为原料在高温下制取铁的化学方程式:
③除了上面的炼铁方法之外,还可用铝热法炼铁,即用铝在高温下把氧化铁中铁置换出来,写出该反应的化学方程式

(1)图(1)A是金属的一个应用实例,利用了金属的
导热
导热
性.图(1)B是两块金属片相互刻划后,在纯铜片上有明显的划痕.该实验探究的目的是
比较合金和纯金属的硬度
比较合金和纯金属的硬度
.(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀
盐酸里的反应现象如右图(2)所示.
①图(3)中Y所代表的金属是
Cu
Cu
(填“Cu”或“Fe”);②Al、Cu、Fe三种金属的活动性由强到弱的顺序为
Al、Fe、Cu
Al、Fe、Cu
;③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
表面形成致密氧化膜
表面形成致密氧化膜
;④将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,好像有一层膜兜着.由此可知氧化铝的熔点
>
>
铝的熔点(填“>”或<”).(3)用一铝制易拉罐收集满一罐CO2气体,加入适量氢氧化钠溶液,封上口,振荡,会发现易拉罐先变瘪,过一段时间后又重新鼓起.
①易拉罐变瘪的原因是(用化学方程式表示)
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.②易拉罐为什么又重新鼓起呢?原来铝是一种特殊的金属,能和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质.已知:在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低.则铝和氢氧化钠溶液反应生成的气体单质是
氢气(H2)
氢气(H2)
.(4)图(4)是工业炼铁的基本生产流程示意图.请回答下列问题:
①写出设备A 的名称:
高炉
高炉
;②写出以赤铁矿为原料在高温下制取铁的化学方程式:
3CO+Fe2O3
2Fe+3CO
| ||
3CO+Fe2O3
2Fe+3CO
;
| ||
③除了上面的炼铁方法之外,还可用铝热法炼铁,即用铝在高温下把氧化铁中铁置换出来,写出该反应的化学方程式
Fe2O3+2Al
2Fe+Al2O3
| ||
Fe2O3+2Al
2Fe+Al2O3
.
| ||
分析:(1)根据锅做饭的原理和合金与组成成分金属的性质差别考虑;(2)①根据铜与氧气反应的现象考虑;②根据金属与酸反应的剧烈程度考虑;③根据铝的氧化物的特点考虑;④根据将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,说明熔点大;(3)①根据二氧化碳与氢氧化钠反应使压强减小考虑;②根据有元素化合价的升高,必然有元素化合价的降低来考虑生成的气体;(4)①根据高炉炼铁的设备考虑;②根据炼铁的原理考虑;③根据方程式的书写考虑.
解答:解:(1)用锅做饭是利用金属的导热性使饭煮熟了;由于合金比它的组成金属的硬度大,所以相互刻划时,在纯铜片上有明显的划痕,说明该实验探究的目的是比较合金和纯金属的硬度;
(2)①由于铜在加热时与氧气反应,生成氧化铜,变为黑色,所以Y所代表的金属是铜;
②金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快,由图示可知铝与盐酸反应速度最剧烈,铁与盐酸反应速度很慢,铜与盐酸不反应,所以金属活动性顺序由强到弱的顺序是:Al、Fe、Cu;
③铝与氧气反应生成一层致密的氧化膜,使里面的铝与外界的氧气不接触,而起到保护作用,所以铝有较强的抗腐蚀性;
④将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,好像有一层膜兜着.由此可知氧化铝的熔点比铝的熔点大;
(3)①由于氢氧化钠与二氧化碳生成碳酸钠和水,使易拉罐内气体压强减小,小于外界大气压,在外界大气压的作用下,易拉罐被压瘪;
②铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质,在反应前后铝的化合价升高,氧、钠元素的化合价不变,因为在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低,根据质量守恒定律可知反应前后元素种类不变,反应物中含有氢元素,生成物中也必须含有氢元素,化合价还必须降低,所以生成的气体是氢气;
(4)①炼铁的设备是高炉;
②高炉炼铁的反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,用观察法配平,反应条件是高温写在等号的上边;
③反应物是氧化铁和铝,生成物是氧化铝和铁,用最小公倍数法配平.
故答案为:(1)导热性;比较合金和纯金属的硬度;(2)①Cu ②Al、Fe、Cu;③表面形成致密氧化膜;④>;(3)①2NaOH+CO2=Na2CO3+H2O;②氢气(H2)(4)①高炉;②3CO+Fe2O3
2Fe+3CO2;③Fe2O3+2Al
2Fe+Al2O3
(2)①由于铜在加热时与氧气反应,生成氧化铜,变为黑色,所以Y所代表的金属是铜;
②金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快,由图示可知铝与盐酸反应速度最剧烈,铁与盐酸反应速度很慢,铜与盐酸不反应,所以金属活动性顺序由强到弱的顺序是:Al、Fe、Cu;
③铝与氧气反应生成一层致密的氧化膜,使里面的铝与外界的氧气不接触,而起到保护作用,所以铝有较强的抗腐蚀性;
④将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,好像有一层膜兜着.由此可知氧化铝的熔点比铝的熔点大;
(3)①由于氢氧化钠与二氧化碳生成碳酸钠和水,使易拉罐内气体压强减小,小于外界大气压,在外界大气压的作用下,易拉罐被压瘪;
②铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质,在反应前后铝的化合价升高,氧、钠元素的化合价不变,因为在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低,根据质量守恒定律可知反应前后元素种类不变,反应物中含有氢元素,生成物中也必须含有氢元素,化合价还必须降低,所以生成的气体是氢气;
(4)①炼铁的设备是高炉;
②高炉炼铁的反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,用观察法配平,反应条件是高温写在等号的上边;
③反应物是氧化铁和铝,生成物是氧化铝和铁,用最小公倍数法配平.
故答案为:(1)导热性;比较合金和纯金属的硬度;(2)①Cu ②Al、Fe、Cu;③表面形成致密氧化膜;④>;(3)①2NaOH+CO2=Na2CO3+H2O;②氢气(H2)(4)①高炉;②3CO+Fe2O3
| ||
| ||
点评:解答本题容易出错的地方是铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质,要根据反应前后元素种类不变,还需要根据在反应前后铝的化合价升高,氧、钠元素的化合价不变,因为在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低,根据质量守恒定律可知反应前后元素种类不变,反应物中含有氢元素,生成物中也必须含有氢元素,化合价还必须降低,所以生成的气体是氢气;

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
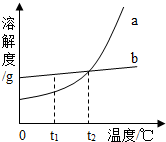 (2012?栖霞区二模)两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )
(2012?栖霞区二模)两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )