题目内容
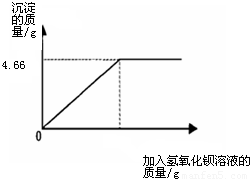
(2010?临沂)对化肥的销售,国家规定了明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示.(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2═BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?| XX牌钾肥 主要成分:K2SO4((K2SO4含量≥86%) 净重:50Kg XX化工有限公司 |
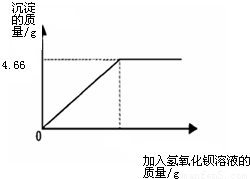
【答案】分析:由标签可知化肥K2SO4含量≥86%,要判断该化肥是否符合包装说明,只要算出4.0g化肥样品中K2SO4的质量分数即可.K2SO4与氢氧化钡发生了如下反应:Ba(OH)2+K2SO4=BaSO4↓+2KOH.读图可知,生成沉淀的质量为4.66g,作为已知量,根据化学方程式可计算出K2SO4的质量,进一步算出化肥的质量分数,与86%比较.
解答:解:①设--------设4.0g钾肥样品中含有硫酸钾的质量为x
②写--------Ba(OH)2+K2SO4=BaSO4↓+2KOH
③找------------------174 233
X 4.66g
④列-------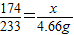
⑤解--------解得:X=3.48g
则这种钾肥样品中硫酸钾的质量分数为: ×100%═87%
×100%═87%
由于87%>86%,该钾肥中硫酸钾的质量分数符合产品包装说明.
⑥答:该钾肥中硫酸钾的质量分数为87%,该产品符合包装说明.
点评:该题属于标签图象型计算题,主要考查读图能力,注意解题的格式要规范.
解答:解:①设--------设4.0g钾肥样品中含有硫酸钾的质量为x
②写--------Ba(OH)2+K2SO4=BaSO4↓+2KOH
③找------------------174 233
X 4.66g
④列-------
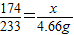
⑤解--------解得:X=3.48g
则这种钾肥样品中硫酸钾的质量分数为:
 ×100%═87%
×100%═87%由于87%>86%,该钾肥中硫酸钾的质量分数符合产品包装说明.
⑥答:该钾肥中硫酸钾的质量分数为87%,该产品符合包装说明.
点评:该题属于标签图象型计算题,主要考查读图能力,注意解题的格式要规范.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
(2010?临沂)对化肥的销售,国家规定了明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示.(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2═BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
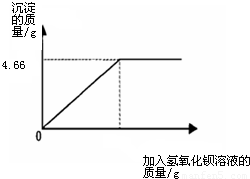
| XX牌钾肥 主要成分:K2SO4((K2SO4含量≥86%) 净重:50Kg XX化工有限公司 |

(2010?临沂)对化肥的销售,国家规定了明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示.(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2═BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
| XX牌钾肥 主要成分:K2SO4((K2SO4含量≥86%) 净重:50Kg XX化工有限公司 |

(2010?临沂)某校化学课外兴趣小组的小刚和小强同学到实验室去做探究实验时,他们意外发现实验桌上有一瓶敞口放置的氢氧化钠固体.根据所学化学知识,他们认为此瓶氢氧化钠固体变质了,接着他们对这瓶氢氧化钠固体变质情况进行了探究.
[提出问题]:氢氧化钠固体变质程度如何?
[查阅资料]:
(1)20℃部分物质的溶解性表
(2)氯化钙和氯化钠溶液呈中性,不能使无色酚酞变色
[猜想与假设]:
小刚猜想:氢氧化钠可能部分变质,生成了碳酸钠.
小强猜想:______.
[实验探究]:小刚和小强设计探究实验方案,证明了他们各自的猜想.探究过程如下:
[得出结论]:小刚的猜想正确.
[表达与交流]:
(1)用化学方程式表示氢氧化钠变质的原因______.
(2)在实验室里氢氧化钠需要密封保存.药品密封保存的原因很多,请你写出浓盐酸需要密封能够保存的原因______.
[提出问题]:氢氧化钠固体变质程度如何?
[查阅资料]:
(1)20℃部分物质的溶解性表
| OH- | NO3- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
[猜想与假设]:
小刚猜想:氢氧化钠可能部分变质,生成了碳酸钠.
小强猜想:______.
[实验探究]:小刚和小强设计探究实验方案,证明了他们各自的猜想.探究过程如下:
| 实验步骤 | 实验操作 | 实验现象 | 实验结论或化学方程式 |
| 步 骤 一 | 取样品,加水配制成溶液,并向其中滴加适量氯化钙溶液,充分反应后过滤 | 有______生成 | 氢氧化钠已变质.写出加入氯化钙溶液后发生反应的化学方程式______. |
| 步 骤 二 | 取上述少量滤液于试管中,滴加无色酚酞溶液 | 酚酞溶液变 为______ 色 | 氢氧化钠部分变质 |
[得出结论]:小刚的猜想正确.
[表达与交流]:
(1)用化学方程式表示氢氧化钠变质的原因______.
(2)在实验室里氢氧化钠需要密封保存.药品密封保存的原因很多,请你写出浓盐酸需要密封能够保存的原因______.