题目内容
制造芯片的高纯硅(硅原子的质子数为14)可以用下述方法制取(反应条件略):
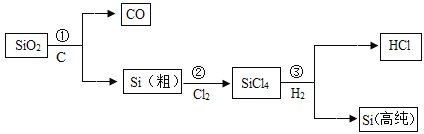
下列有关说法错误的是
A.硅原子在化学变化中容易得电子
B.SiCl4中Si的化合价为+4
C.反应①、③均为置换反应
D.硅原子的核电荷数为14
下表是 20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液:配制 50g11%氢氧化钠溶液的基本步骤是:计算—称取氢氧化钠固体—量取水—溶解—装瓶贴标签。 用托盘天平称取氢氧化钠固体的质量_________ g。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向稀氢氧化钠溶液中通入 CO2,先生成 Na2CO3,继续通入 CO2,Na2CO3 会转化为 NaHCO3,已知后者为化合反应,请写出该化合反应的化学方程式:_________。 若向 20℃时饱和 Na2CO3 溶液中通入过量的 CO2,可观察到的现象是_________。
②结合表格中的有关数据,若以 20℃时,100g 饱和溶液吸收 CO2 的质量最大为依据,则除去 CO 气体中的 CO2 杂质,应选择_________溶液(填化学式),欲检验CO2气体的存在,则应选择_________溶液(填化学式)。
③将 2.2g CO2 通入 47.8g 一定浓度的 NaOH溶液中充分反应后(反应过程中没有CO2 逸出,水也没有蒸发),溶液中的溶质仅有 Na2CO3和 NaHCO3 两种物质(NaHCO3 在水中电离成 Na+和 HCO3-),则此时溶液中碳元素的质量分数为__________,在此反应过程中,你认为钠离子的个数_________发生变化?(填写: 有或者没有)
(3)电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份置于两个烧杯中 并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法正确的是__________
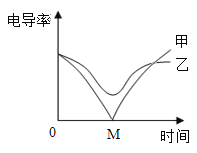
a.乙曲线电导率减小过程中,溶液由红色变为无色
b.乙曲线对应的反应中四种离子数目都减少
c.甲曲线对应氢氧化钡与硫酸钠反应
d.甲曲线上的 M 点代表两种溶液恰好完全反应



