题目内容
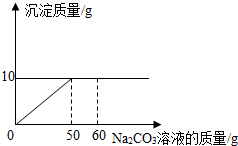 将14.4g含有NaCl和CaCl2的固体混合物,加入到45.6g的足量的水中,在所得溶液中逐滴加入一定定溶质质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量质量与沉淀质量关系如图:(化学方程式 CaCl2+Na2CO3═CaCO3↓+2NaCl)
将14.4g含有NaCl和CaCl2的固体混合物,加入到45.6g的足量的水中,在所得溶液中逐滴加入一定定溶质质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量质量与沉淀质量关系如图:(化学方程式 CaCl2+Na2CO3═CaCO3↓+2NaCl)(1)求Na2CO3溶液的溶质质量分数;
(2)原混合溶液中CaCl2的质量;
(3)当CaCl2和Na2CO3恰好完全反应时,过滤,求所得溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据沉淀的质量和化学方程式求出碳酸钠的质量,进而求质量分数;
(2)根据沉淀的质量和化学方程式求出氯化钙的质量;
(3)所得溶液中溶质为反应生成的和原混合物中存在的.
(2)根据沉淀的质量和化学方程式求出氯化钙的质量;
(3)所得溶液中溶质为反应生成的和原混合物中存在的.
解答:解:设溶液中Na2CO3的质量为x,混合物中CaCl2的质量为y,生成NaCl的质量为z
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100 117
y x 10g z
=
=
=
x=10.6g,y=11.1g,z=11.7g
(1)Na2CO3溶液的溶质质量分数:
×100%=21.2%;
(2)CaCl2的质量为11.1g;
(3)所得溶液中溶质的质量分数为:
×100%=15%.
答:(1)Na2CO3溶液的溶质质量分数为21.2%;
(2)CaCl2的质量为11.1g;
(3)所得溶液中溶质的质量分数为15%.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100 117
y x 10g z
| 111 |
| y |
| 106 |
| x |
| 100 |
| 10g |
| 117 |
| z |
x=10.6g,y=11.1g,z=11.7g
(1)Na2CO3溶液的溶质质量分数:
| 10.6g |
| 50g |
(2)CaCl2的质量为11.1g;
(3)所得溶液中溶质的质量分数为:
| 14.4g-11.1g+11.7g |
| 14.4g+45.6g+50g-10g |
答:(1)Na2CO3溶液的溶质质量分数为21.2%;
(2)CaCl2的质量为11.1g;
(3)所得溶液中溶质的质量分数为15%.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物的质量+所加水的质量+所加入碳酸钠溶液的质量-生成沉淀的质量,可使溶液的计算简便许多.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
在盛有水的烧杯中加入以下某种物质形成溶液过程中,温度下降.这种物质是( )
| A、氯化钠 | B、硝酸铵 |
| C、氢氧化钠 | D、氧化钙 |
加热24.5g KClO3和8.2g MnO2的混合物,反应完全后得到14.9g KCl.根据质量守恒定律,确定生成的氧气的质量为( )
| A、6.7g | B、39.4g |
| C、9.6g | D、17.8g |
下列变化不属于化学变化的是( )
| A、金属锈蚀 |
| B、蒸发分离液态空气制氧气 |
| C、铁丝燃烧 |
| D、火药爆炸 |
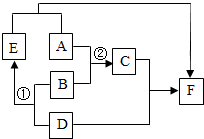 A-F均为初中化学常见的物质,其转化过程如图所示,已知A,D均为黑色固体(D为常见金属)B为胃酸的主要成分,C为蓝色溶液,D,E,F均为单质(部分生成物及反应条件已省略)
A-F均为初中化学常见的物质,其转化过程如图所示,已知A,D均为黑色固体(D为常见金属)B为胃酸的主要成分,C为蓝色溶液,D,E,F均为单质(部分生成物及反应条件已省略)
 如图示,进行酸碱中和实验,先往试管里倒入2mL氢氧化钠溶液,再滴入几滴
如图示,进行酸碱中和实验,先往试管里倒入2mL氢氧化钠溶液,再滴入几滴