题目内容
铜器长时间露置在潮湿的空气里,表面都会有一层绿色的物质,俗称铜绿,化学名称:碱式碳酸铜[Cu2( OH )2 CO3].请完成下列问题.
(1)根据其化学式,得出铜生锈可能是铜与空气中的氧气、水和 共同反应的结果.
【问题探究】
研究小组欲探究一表面生锈的铜片中铜绿的质量分数,称取该样品10.0g放入D中进行如图实验:
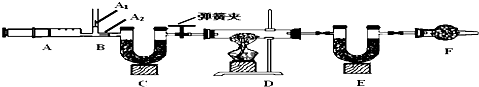
【查阅资料】
1.铜绿不稳定,加热时易分解成三种氧化物.
2.C、E、F中装有碱石灰(CaO与NaOH的固体混合物),碱石灰可以用来吸收二氧化碳和水蒸气;
3.B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭,推拉注射器的作用是鼓入空气.
【实验步骤】
①组装好装置
②反复推拉注射器
③称量E的质量
④关闭弹簧夹,加热D处试管直到反应不再进行
⑤打开弹簧夹,再次反复缓缓推拉注射器
⑥再次称量E的质量.
【实验分析】
(2)写出D装置中发生的两个化学方程式
①铜绿受热分解的化学方程式 ,绿色粉末逐渐变为 色.
②铜加热 .
(3)在操作①中,同学们一致认为缺少了一个重要步骤,在实验前应先 .
(4)C的作用是 ,F的作用是 .
(5)步骤⑤的作用是 .若不进行步骤⑤的操作,则所测得的铜绿的质量分数 (填“偏大”、“偏小”、“无影响”).
【定量计算】
(6)反应结束后,测得E装置的质量增加了0.62g,则铜绿在样品中所占质量分数为 .
【实验反思】
(7)小明同学提出可以通过测D装置反应后的质量的减少即为反应生成的水和二氧化碳来计算,同学们经过思考否定了这种方案,理由是 .
【实验再探究】
【查阅资料】
1.铜绿可与稀硫酸反应生成硫酸铜、水以及一种能使石灰水变浑浊的气体.
2.含有硫酸根离子的化合物溶液与氯化钡溶液反应会产生白色沉淀.
【实验方案】
取10g表面生锈的铜样品,加入稍过量的稀硫酸,充分反应后过滤,洗涤,干燥,称得滤渣的质量即为铜的质量.
(8)写出铜绿与硫酸反应的化学方程式 .
(9)证明所加稀硫酸过量的现象是 ,滤液中含有的溶质有 和 .
(10)判断滤渣铜已洗涤干净的操作方法及现象是 .
(1)根据其化学式,得出铜生锈可能是铜与空气中的氧气、水和
【问题探究】
研究小组欲探究一表面生锈的铜片中铜绿的质量分数,称取该样品10.0g放入D中进行如图实验:

【查阅资料】
1.铜绿不稳定,加热时易分解成三种氧化物.
2.C、E、F中装有碱石灰(CaO与NaOH的固体混合物),碱石灰可以用来吸收二氧化碳和水蒸气;
3.B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭,推拉注射器的作用是鼓入空气.
【实验步骤】
①组装好装置
②反复推拉注射器
③称量E的质量
④关闭弹簧夹,加热D处试管直到反应不再进行
⑤打开弹簧夹,再次反复缓缓推拉注射器
⑥再次称量E的质量.
【实验分析】
(2)写出D装置中发生的两个化学方程式
①铜绿受热分解的化学方程式
②铜加热
(3)在操作①中,同学们一致认为缺少了一个重要步骤,在实验前应先
(4)C的作用是
(5)步骤⑤的作用是
【定量计算】
(6)反应结束后,测得E装置的质量增加了0.62g,则铜绿在样品中所占质量分数为
【实验反思】
(7)小明同学提出可以通过测D装置反应后的质量的减少即为反应生成的水和二氧化碳来计算,同学们经过思考否定了这种方案,理由是
【实验再探究】
【查阅资料】
1.铜绿可与稀硫酸反应生成硫酸铜、水以及一种能使石灰水变浑浊的气体.
2.含有硫酸根离子的化合物溶液与氯化钡溶液反应会产生白色沉淀.
【实验方案】
取10g表面生锈的铜样品,加入稍过量的稀硫酸,充分反应后过滤,洗涤,干燥,称得滤渣的质量即为铜的质量.
(8)写出铜绿与硫酸反应的化学方程式
(9)证明所加稀硫酸过量的现象是
(10)判断滤渣铜已洗涤干净的操作方法及现象是
分析:(1)根据碱式碳酸铜化学式和质量守恒定律,推测;
(2)根据反应物、反应条件、生成物,可以书写铜绿受热分解和铜加热的化学方程式;
(3)有气体参与反应或需要气体反应的装置,都必须检查装置气密性;
(4)利用碱石灰的作用回答;
(5)打开弹簧夹,再次反复缓缓推拉注射器,即让生成的二氧化碳和水充分被E吸收;
(6)反应结束后,测得E装置的质量增加了0.62g,则可知二氧化碳和水的质量,则可求铜绿在样品中所占质量分数.
(7)知道:E装置增加的质量即为反应生成的水和二氧化碳.
(8)根据资料“铜绿可与稀硫酸反应生成硫酸铜、水以及一种能使石灰水变浑浊的气体”,则可知铜绿与硫酸反应的化学方程式.
(9)根据资料“含有硫酸根离子的化合物溶液与氯化钡溶液反应会产生白色沉淀”,则可证明所加稀硫酸是否过量;
(10)利用称量E装置的质量是否增加,判断滤渣铜已洗涤干净.
(2)根据反应物、反应条件、生成物,可以书写铜绿受热分解和铜加热的化学方程式;
(3)有气体参与反应或需要气体反应的装置,都必须检查装置气密性;
(4)利用碱石灰的作用回答;
(5)打开弹簧夹,再次反复缓缓推拉注射器,即让生成的二氧化碳和水充分被E吸收;
(6)反应结束后,测得E装置的质量增加了0.62g,则可知二氧化碳和水的质量,则可求铜绿在样品中所占质量分数.
(7)知道:E装置增加的质量即为反应生成的水和二氧化碳.
(8)根据资料“铜绿可与稀硫酸反应生成硫酸铜、水以及一种能使石灰水变浑浊的气体”,则可知铜绿与硫酸反应的化学方程式.
(9)根据资料“含有硫酸根离子的化合物溶液与氯化钡溶液反应会产生白色沉淀”,则可证明所加稀硫酸是否过量;
(10)利用称量E装置的质量是否增加,判断滤渣铜已洗涤干净.
解答:解:(1)根据碱式碳酸铜化学式[Cu2( OH )2 CO3]和质量守恒定律,则得出铜生锈可能是铜与空气中的氧气、水和 二氧化碳共同反应的结果.
【实验分析】
(2)①根据反应物、反应条件、生成物,可以书写铜绿受热分解的化学方程式 Cu2(OH)2CO3
2CuO+H2O+CO2↑,绿色粉末逐渐变为 黑色.
②根据反应物、反应条件、生成物,可以书写铜加热的化学方程式 2Cu+O2
2CuO.
(3)在操作①中,实验前应先 检查装置的气密性.
(4)根据“碱石灰(CaO与NaOH的固体混合物),碱石灰可以用来吸收二氧化碳和水蒸气”,则可推测C的作用是 吸收二氧化碳和水蒸气,F的作用是 防止空气中的二氧化碳和水蒸气等杂质气体进入到E,影响二氧化碳和水分质量的测定.
(5)步骤⑤该操作中推注射器时缓缓的目的是使生成的二氧化碳、水蒸气吸收充分.若不进行步骤⑤的操作,生成的二氧化碳和水不能被充分吸收,使得结果偏小.故填:偏小.
(6)反应结束后,测得E装置的质量增加了0.62g,则二氧化碳和水的质量为0.62g,则碱式碳酸铜的质量为2.22g,故样品中所占质量分数为
×100%=22.2%.
(7)小明同学提出可以通过测D装置反应后的质量的减少即为反应生成的水和二氧化碳来计算,同学们经过思考否定了这种方案,理由是 E装置增加的质量即为反应生成的水和二氧化碳.
(8)根据资料“铜绿可与稀硫酸反应生成硫酸铜、水以及一种能使石灰水变浑浊的气体”,则可写出铜绿与硫酸反应的化学方程式 Cu2(OH)2CO3 +2H2SO4=2CuSO4+3H2O+CO2↑.
(9)根据资料“含有硫酸根离子的化合物溶液与氯化钡溶液反应会产生白色沉淀”,则可证明所加稀硫酸过量的现象是 与氯化钡溶液反应会产生白色沉淀,滤液中含有的溶质有 氯化氢和 硫酸铜.
(10)判断滤渣铜已洗涤干净的操作方法及现象是 称量E装置的质量不再增加.
故答案为:(1)二氧化碳;
(2)①Cu2(OH)2CO3
2CuO+H2O+CO2↑,黑.②2Cu+O2
2CuO.
(3)检查装置的气密性.
(4)吸收二氧化碳和水蒸气,防止空气中的二氧化碳和水蒸气等杂质气体进入到E,影响二氧化碳和水分质量的测定.
(5)使碱石灰充分吸收二氧化碳和水蒸气.偏小
(6)22.2%.
(7)E装置增加的质量即为反应生成的水和二氧化碳.
(8)Cu2(OH)2CO3 +2H2SO4=2CuSO4+3H2O+CO2↑.
(9)与氯化钡溶液反应会产生白色沉淀,氯化氢和 硫酸铜.
(10)称量E装置的质量不再增加
【实验分析】
(2)①根据反应物、反应条件、生成物,可以书写铜绿受热分解的化学方程式 Cu2(OH)2CO3
| ||
②根据反应物、反应条件、生成物,可以书写铜加热的化学方程式 2Cu+O2
| ||
(3)在操作①中,实验前应先 检查装置的气密性.
(4)根据“碱石灰(CaO与NaOH的固体混合物),碱石灰可以用来吸收二氧化碳和水蒸气”,则可推测C的作用是 吸收二氧化碳和水蒸气,F的作用是 防止空气中的二氧化碳和水蒸气等杂质气体进入到E,影响二氧化碳和水分质量的测定.
(5)步骤⑤该操作中推注射器时缓缓的目的是使生成的二氧化碳、水蒸气吸收充分.若不进行步骤⑤的操作,生成的二氧化碳和水不能被充分吸收,使得结果偏小.故填:偏小.
(6)反应结束后,测得E装置的质量增加了0.62g,则二氧化碳和水的质量为0.62g,则碱式碳酸铜的质量为2.22g,故样品中所占质量分数为
| 2.22g |
| 10.0g |
(7)小明同学提出可以通过测D装置反应后的质量的减少即为反应生成的水和二氧化碳来计算,同学们经过思考否定了这种方案,理由是 E装置增加的质量即为反应生成的水和二氧化碳.
(8)根据资料“铜绿可与稀硫酸反应生成硫酸铜、水以及一种能使石灰水变浑浊的气体”,则可写出铜绿与硫酸反应的化学方程式 Cu2(OH)2CO3 +2H2SO4=2CuSO4+3H2O+CO2↑.
(9)根据资料“含有硫酸根离子的化合物溶液与氯化钡溶液反应会产生白色沉淀”,则可证明所加稀硫酸过量的现象是 与氯化钡溶液反应会产生白色沉淀,滤液中含有的溶质有 氯化氢和 硫酸铜.
(10)判断滤渣铜已洗涤干净的操作方法及现象是 称量E装置的质量不再增加.
故答案为:(1)二氧化碳;
(2)①Cu2(OH)2CO3
| ||
| ||
(3)检查装置的气密性.
(4)吸收二氧化碳和水蒸气,防止空气中的二氧化碳和水蒸气等杂质气体进入到E,影响二氧化碳和水分质量的测定.
(5)使碱石灰充分吸收二氧化碳和水蒸气.偏小
(6)22.2%.
(7)E装置增加的质量即为反应生成的水和二氧化碳.
(8)Cu2(OH)2CO3 +2H2SO4=2CuSO4+3H2O+CO2↑.
(9)与氯化钡溶液反应会产生白色沉淀,氯化氢和 硫酸铜.
(10)称量E装置的质量不再增加
点评:解答本题的关键是要充分理解物质的性质和实验目的,只有这样才能对问题做出正确的判断.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目