题目内容
【题目】下列各组含氯元素的物质中,氯元素化合价相同的一组是![]()
A. ![]() HCl B.
HCl B. ![]()
![]()
C. NaClHClO D. ![]()
![]()
【答案】D
【解析】A、因单质中元素化合价为0,则Cl2中Cl元素的化合价为0,在HCl中H为+1价,则Cl元素为-1价,Cl元素化合价不相同,错误;B、NaClO2中Na元素为+1价,O元素为-2价,则Cl元素为+3价,而ClO2中O元素为-2价,则Cl元素为+4价,Cl元素化合价不同,错误;C、HClO中H元素为+1价,O元素为-2价,则Cl元素为+1价,而NaCl中Na元素为+1价,Cl元素为-1价,Cl元素化合价不同,错误;D、KClO3中K元素为+1价,O元素为-2价,则Cl元素为+5价,而Ca(ClO3)2中Ca元素为+2价,O元素为-2价,则Cl元素为+5价,Cl元素化合价相同,正确。故选D。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
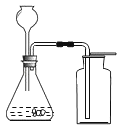
黄冈创优卷系列答案【题目】某校实验小组取酸性锌锰干电池进行探究,他们发现电池内部结构如图1所示。
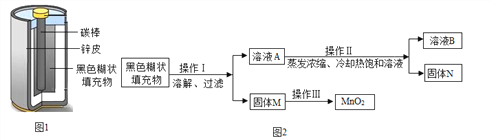
【查阅资料】
⑴锌皮为金属锌(含有少量的铁)
⑵黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl等组成
⑶有关数据见下表
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
【实验探究一】小明取适量黑色糊状填充物,按图2所示实验流程进行探究。
⑴溶液A中溶质主要有ZnC12和NH4Cl,操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是______________________;
⑵欲从固体M 中得到较纯的MnO2,操作Ⅲ可采用的简便方法是_________。
【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
⑴取一块锌皮放入盛有适量稀盐酸的烧杯中, 实验中可观察到的现象是_____________有关反应的化学方程式___________________________。
⑵下列各组物质混合后,也能生成ZnCl2的有_______(填字母序号)。
A. ZnO与稀盐酸 B. Zn与NaCl溶液 C. Zn(NO3)2溶液与NH4Cl溶液
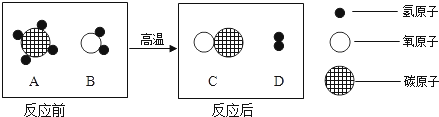
【题目】实验研究是化学学习的重要方法。请以碳及其化合物的知识进行以下实验研究。
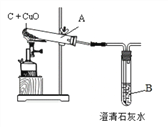
实验一:木炭还原氧化铜。
①观察到B中溶液变浑浊,试管A中的现象_______________,
A中反应的化学方程式为________,还原剂是__________。
②反应完全后,若先撤走酒精喷灯停止加热,可能导致的后果___________________________
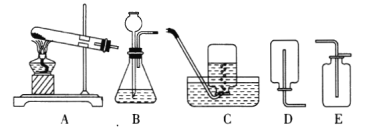
实验二:为了探究某混合气体是由水蒸气、一氧化碳、二氧化碳3种气体组成, 设计了如下实验:
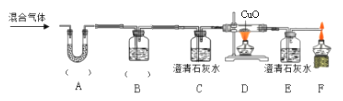
①欲探究混合气体中含有CO2和H2O蒸气,在图中的A、B装置内依次盛放的化学试剂为_______;检验出水蒸气的现象是_____________,反应的化学方程式为__________。
②装置E、F的作用分别是__________________ 、_____________________,E中反应的化学方程式为_____________。
③若没有装置E_______________(填“能”或“否”)证明混合气体中含有一氧化碳,请简述理由_____________________。
④实验结束后先熄灭装置D处的酒精灯,E中石灰水不会倒流的原因是____________。
⑤该实验中体现的一氧化碳的化学性质有__________________________。
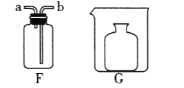
实验三:有些化妆品中添加的高纯度碳酸钙可以用石灰石来制备,如下图。(假设石灰石中除碳酸钙外。所含杂质仅为SiO2,其不溶于水,高温不会分解,也不与盐酸反应)
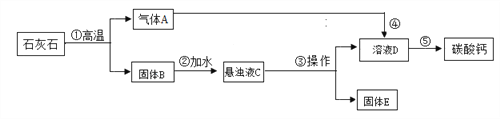
Ⅰ. 写出步骤①②中反应的化学方程式____________、____________。
Ⅱ. 气体A能使紫色石蕊试液变红色,反应的化学方程式为____________ 。
Ⅲ. 操作⑤的目的是________,用到的仪器主要有玻璃棒、酒精灯、铁架台(带铁圈)、__________。
Ⅳ. 为验证实验结束后得到的固体B中碳酸钙是否已经完全分解,请设计两种方案完成下表内容。
实验步骤 | 实验现象 | 结论 | |
方案一(66) | ________________ | ________________ | ________________ |
方案二(67) | ________________ | ________________ | ________________ |
【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度。(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①由表可知,20℃时,氯化钠的溶解度是________。影响硝酸钾溶解度的因素是_________。
②在80℃的100g水中溶解NaCl和KNO3,进行以下实验:
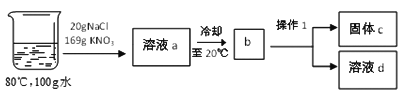
Ⅰ.操作1的名称是_________。
Ⅱ.溶液a冷却至b的过程中出现的现象是__________。溶液d中所含的溶质是_________。
Ⅲ.对整个实验过程分析正确的是_________。
A.无法判断a、d溶液中氯化钠溶液的状态 B.固体c是纯净物
C.溶液a中硝酸钾的质量分数为![]() D.硝酸钾溶液始终处于饱和状态
D.硝酸钾溶液始终处于饱和状态