题目内容
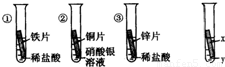
(2008?西宁)化学小组为探究铁,铜.锌.银的金属活动性顺序,设计了如图三个实验(其中金属均已打磨,其形状、大小、及稀盐酸的用量均相同).(1)小强同学认为通过实验①和③可以比较铁和锌的金属活动性,他依据的实验现象是;
(2)一段时间后.观察到实验②的铜片表面有银白色固体附着.这说明铜比银的活泼性(填“强”或“弱”).该反应的化学方程式为;
(3)小华和小红两位同学认为上述实验方案不足以得出四种金属的活动性顺序,并在上述实验的基础上,利用金属的不同的化学性质分别补充了一个实验(如图所示),都实现了探究目的.小华同学的实验:X是金属,Y是溶液;小红同学的实验:X是金属,Y是溶液.
【答案】分析:根据题意可知本题比较金属的活泼性,主要是利用了金属与酸、与盐溶液的反应来得出结论的.Zn、Fe都与盐酸反应但快慢不同,Cu能与硝酸银溶液反应置换出Ag,难点是怎么比较Fe和Cu,需另设计实验,但出发点仍是利用金属与酸、与盐溶液的反应.
解答:解:(1)通过实验①和③的现象可知,Zn与盐酸反应剧烈,故答案为:锌与稀盐酸反应产生气泡的速度比铁的快.(2)通过观察到实验②的铜片表面有银白色固体附着,可知银白色固体为银,铜与与硝酸银溶液反应生成了银,所以铜比银活泼,故答案为:强;Cu+2AgNO3=Cu(NO3)2+2Ag
(3)根据以上实验只能得出金属的活泼性Zn>Fe,Cu>Ag,关键是比较Fe>Cu,若是利用金属与盐溶液反应,可设计让铁与含Cu2+的溶液反应,故答案为:X是Fe(或铁),Y是CuSO4(硫酸铜)或氯化铜或硝酸铜;若是利用金属与酸反应,可设计铜与稀酸反应,因为铁能与酸反应,当看到铜不与稀酸反应,就可得出活泼性Fe>Cu,故答案为X是Cu(或铜),Y是HCI(或稀盐酸)或稀硫酸.
点评:本题考查了学生的实验设计能力,属于能力提高型习题,且本题具有开放性,学生的思维空间较大,如(3)中Y的选择,能培养学生创新设计的能力.开放型习题有助于学生对知识的综合应用.
解答:解:(1)通过实验①和③的现象可知,Zn与盐酸反应剧烈,故答案为:锌与稀盐酸反应产生气泡的速度比铁的快.(2)通过观察到实验②的铜片表面有银白色固体附着,可知银白色固体为银,铜与与硝酸银溶液反应生成了银,所以铜比银活泼,故答案为:强;Cu+2AgNO3=Cu(NO3)2+2Ag
(3)根据以上实验只能得出金属的活泼性Zn>Fe,Cu>Ag,关键是比较Fe>Cu,若是利用金属与盐溶液反应,可设计让铁与含Cu2+的溶液反应,故答案为:X是Fe(或铁),Y是CuSO4(硫酸铜)或氯化铜或硝酸铜;若是利用金属与酸反应,可设计铜与稀酸反应,因为铁能与酸反应,当看到铜不与稀酸反应,就可得出活泼性Fe>Cu,故答案为X是Cu(或铜),Y是HCI(或稀盐酸)或稀硫酸.
点评:本题考查了学生的实验设计能力,属于能力提高型习题,且本题具有开放性,学生的思维空间较大,如(3)中Y的选择,能培养学生创新设计的能力.开放型习题有助于学生对知识的综合应用.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目