题目内容
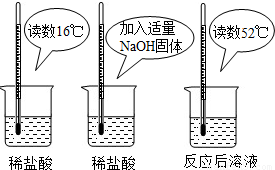
(2009?浦东新区二模)氢氧化钠与盐酸发生中和反应的化学方程式为______,(1)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:根据下图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是______;丙同学认为:通过多个实验才能得出一个普遍的结论.请你再举出一个酸碱中和反应的实例,写出反应物的化学式______.
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A,、B,C,D,E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
交流反思:反应后,烧杯内溶液pH最小的是______(填烧杯编号).
【答案】分析:氢氧化钠能与盐酸反应生成氯化钠和水,该反应为放热反应,氢氧化钠固体溶于水会放出大量的热,根据表格提供的数据可以发现,放出热量的多少与盐酸的浓度有关,反应后D和E溶液的温度相同,说明E中的盐酸没有全部参加反应,溶液呈酸性,故其pH最小.
解答:解:
氢氧化钠能与盐酸反应生成氯化钠和水,所以本题答案为:NaOH+HCl═NaCl+H2O;
(1)氢氧化钠固体溶于水会放出大量的热,该反应中使用的是氢氧化钠固体,不足以说明反应放热,氢氧化钙能与硝酸反应生成硝酸钙和水,所以本题答案为:氢氧化钠固体溶于水也会放出大量的热,Ca(OH)2+2HNO3═Ca(NO3)2+2H2O;
(2)根据表格提供的数据可以发现,放出热量的多少与盐酸的浓度有关,反应后D和E溶液的温度相同,说明E中的盐酸没有全部参加反应,溶液呈酸性,故其pH最小,所以本题答案为:盐酸的浓度越大,放出的热量越多,参加反应的物质(或生成的物质)的量越多,放出的热量越多,E.
点评:本题考查了酸碱中和的知识,完成此题,可以依据酸和碱的性质进行,要学会从表格提供的数据中分析从而得出结论.
解答:解:
氢氧化钠能与盐酸反应生成氯化钠和水,所以本题答案为:NaOH+HCl═NaCl+H2O;
(1)氢氧化钠固体溶于水会放出大量的热,该反应中使用的是氢氧化钠固体,不足以说明反应放热,氢氧化钙能与硝酸反应生成硝酸钙和水,所以本题答案为:氢氧化钠固体溶于水也会放出大量的热,Ca(OH)2+2HNO3═Ca(NO3)2+2H2O;
(2)根据表格提供的数据可以发现,放出热量的多少与盐酸的浓度有关,反应后D和E溶液的温度相同,说明E中的盐酸没有全部参加反应,溶液呈酸性,故其pH最小,所以本题答案为:盐酸的浓度越大,放出的热量越多,参加反应的物质(或生成的物质)的量越多,放出的热量越多,E.
点评:本题考查了酸碱中和的知识,完成此题,可以依据酸和碱的性质进行,要学会从表格提供的数据中分析从而得出结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目