题目内容
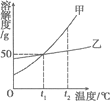
【题目】将40 g氢氧化钠溶液逐滴加入到20 g溶质质量分数为0. 365%的稀盐酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液的pH变化如左图所示,溶液的温度变化如右图所示。试回答:
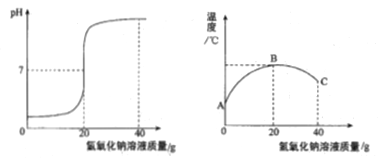
(1)上右图从A到B过程中,溶液的pH逐渐________(填“增大”或“减小”)。
(2)上右图从B到C过程中,溶液温度降低的原因是_____________。
(3)C点对应的溶液中含有的微粒有____________(用符号表示)。
(4)计算氢氧化钠溶液的溶质质量分数。(写出计算过程)_________________________
【答案】 增大 加入温度较低的氢氧化钠溶液起到冷却的作用 Na+、Cl-、OH-、H2O 0.4%
【解析】本题主要考查了根据化学方程式的计算,中和反应的实质和中和反应是放热反应的知识。
(1)由图像可知,A到B过程中溶液的温度不断升高,在反应进行过程中,随着氢氧化钠溶液的加入,盐酸不断消耗,溶液的pH逐渐增大;
(2)B到C过程是反应已经结束,不断加入氢氧化钠的过程,反应得到的溶液的温度较高,加入的氢氧化钠溶液的温度较低。从B到C过程中,溶液温度降低的原因是加入温度较低的氢氧化钠溶液起到冷却的作用;
(3)B到C过程是反应已经结束,不断加入氢氧化钠的过程,在C点时,氢氧化钠已过量,C点溶液中的溶质中有生成的氯化钠和过量的氢氧化钠,C点对应的溶液中含有的微粒有Na+、Cl-、OH-、H2O;
(4)由图像可知,恰好酸碱中和时消耗氢氧化钠的质量是20g
20 g溶质质量分数为0. 365%的稀盐酸中的溶质质量=20g×0.365%=0.073g
设:20g的氢氧化钠溶液中溶质的质量为x
HCl + NaOH═NaCl+H2O,
36.5 40
0.073g x
![]() 解得x=0.08g
解得x=0.08g
氢氧化钠溶液中溶质的质量分数=![]() ×100%=0.4%。
×100%=0.4%。

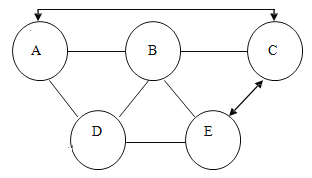
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
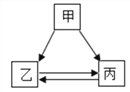
选项 | 甲 | 乙 | 丙 |
A | C | CO2 | CO |
B | H2O2 | O2 | H2O |
C | CuO | Cu | CuSO4 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D