题目内容
要想得到8克氧化镁,需多少克镁条?同时消耗多少克氧气?
解:设需镁条的质量为x,
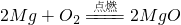
48 80
x 8g
∴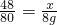
∴x= =4.8g;
=4.8g;
根据质量守恒定律,氧气的质量=8g-4.8g=3.2g.
答;要想得到8克氧化镁,需4.8克镁条,同时消耗3.2克氧气.
分析:利用镁在氧气中燃烧的化学方程式和生成氧化镁的质量,列出比例式,即可计算出需镁条的质量;根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以消耗氧气的质量=生成氧化镁的质量-镁条的质量.
点评:本题主要考查学生利用化学方程式和质量守恒定律进行计算的能力.利用质量守恒定律,求出消耗氧气的质量,就可以顺利解题.
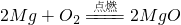
48 80
x 8g
∴
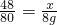
∴x=
 =4.8g;
=4.8g;根据质量守恒定律,氧气的质量=8g-4.8g=3.2g.
答;要想得到8克氧化镁,需4.8克镁条,同时消耗3.2克氧气.
分析:利用镁在氧气中燃烧的化学方程式和生成氧化镁的质量,列出比例式,即可计算出需镁条的质量;根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以消耗氧气的质量=生成氧化镁的质量-镁条的质量.
点评:本题主要考查学生利用化学方程式和质量守恒定律进行计算的能力.利用质量守恒定律,求出消耗氧气的质量,就可以顺利解题.

练习册系列答案
相关题目