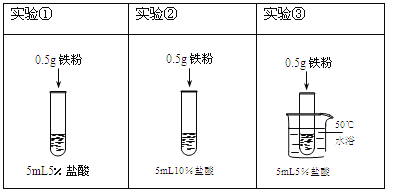
��Ŀ����
����Ŀ���������ƣ�CaO2����һ�ֶ���������ͨ����Ca(OH)2Ϊԭ���Ƶã��Ʊ��������£�
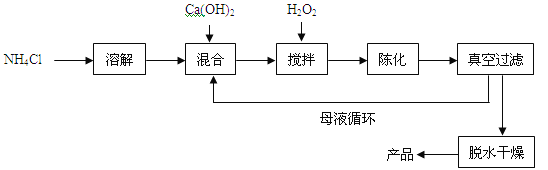
��1��ԭ����NH4Cl�е�Ԫ�صĻ��ϼ��� ��NH4Cl����Ԫ�ص���������Ϊ %����ȷ�� 0.1%����
��2���뽫��������з�����Ӧ�Ļ�ѧ����ʽ����������
CaCl2 + H2O2 + 2NH3��H2O + 6 = CaO2��8H2O��+ 2NH4Cl���Ʊ������г�ˮ���ѭ��ʹ�õ������� ���ѧʽ����
���𰸡���1��-3��26.2%
��2��H2O�� NH4Cl
��������
���������NH4Cl�е�Ԫ�صĻ��ϼ���ΪX����X+��+1����4+��-1��=0 X= -3��NH4Cl����Ԫ�ص���������=14��53.5��100%=26.2%�����������غ㶨�ɿ���֪���μӷ�Ӧ�ĸ���ԭ�ӵ��������������ı䣬���Ը�������H2O���Ʊ������г�ˮ���ѭ��ʹ�õ�������NH4Cl��

��ϰ��ϵ�д�
 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
�����Ŀ