题目内容
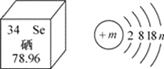
【题目】某粒子的结构示意图如图
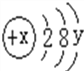
(1)若该粒子为一稀有气体元素的原子,则x=______,y=______.
(2)若该粒子为R2+,则x=______,y=______.
(3)若该粒子为Mn-,则x=______,y=______.
【答案】 18 8 22 0 18 18-n
【解析】(1)稀有气体元素的原子最外层电子个数是8(氦除外),y=8,原子中质子数=核外电子数,故x=2+8+8=18。 (2)最外层是8个电子的结构是稳定结构,粒子R2+的最外层有8个电子,故y=8。R2+粒子,是R原子失去了2个电子,原子中质子数=核外电子数,x=2+8+8+2=22。(3)最外层是8个电子的结构是稳定结构,粒子Mn-的最外层有8个电子,故y=8。Mn-粒子,是M原子得到了n个电子后有2+8+8=18个电子,原子中质子数=核外电子数,故x=18-n。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程:____________________________。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
【完成实验】按下表进行实验,并测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比1:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
【分析数据、得出结论】(1)由实验_______与实验4对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是_________________。
【反思】(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的_______和_________不变;
(2)画图(在下面空白处画出实验室高锰酸钾制取并收集氧气的装置图)_____________。
(3)同种催化剂,还有哪些因素可能影响催化效果,请你再探究(探究一种因素即可)________________。