题目内容
 有等质量的M、N两金属,相对原子质量Ar(M)<Ar(N),将M放入质量分数为10%的稀硫酸中,B放入质量分数为10%的稀盐酸中,在反应中M、N均为正二价,产生H2的质量随反应时间变化曲线如图.下列正确的说法是( )
有等质量的M、N两金属,相对原子质量Ar(M)<Ar(N),将M放入质量分数为10%的稀硫酸中,B放入质量分数为10%的稀盐酸中,在反应中M、N均为正二价,产生H2的质量随反应时间变化曲线如图.下列正确的说法是( )| A、产生氢气的速率M<N |
| B、反应后M、N一定都有剩余 |
| C、消耗的稀硫酸和稀盐酸质量一定不相等 |
| D、消耗N的质量一定小于M的质量 |
考点:金属的化学性质
专题:金属与金属材料
分析:根据图象可以得出:①比较氢气的多少,根据氢气的质量=
×金属的质量,从而可以判断出金属的相对原子质量的大小,得到氢气多的则相对原子质量小;②判断金属的活动性强弱,反应时间短或斜线斜率大的则该金属的活动性强.
| 金属的化合价 |
| 金属的相对原子质量 |
解答:解:
A、根据图象不难看出,金属M完全反应后所需要的时间短,即产生氢气的速率M>N,故A错误;
B、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,可能都剩余;故B错误;
C、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,又因这两种酸溶液中溶质的质量分数相同,从而说明参与反应的两种酸的质量一定不一样多,故C正确;
D、由于M的相对原子质量小,因此得到相同质量的氢气,参加反应的金属M的质量要少一些,即消耗N的质量一定大于M的质量,故D错误;
故选:C.
A、根据图象不难看出,金属M完全反应后所需要的时间短,即产生氢气的速率M>N,故A错误;
B、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,可能都剩余;故B错误;
C、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,又因这两种酸溶液中溶质的质量分数相同,从而说明参与反应的两种酸的质量一定不一样多,故C正确;
D、由于M的相对原子质量小,因此得到相同质量的氢气,参加反应的金属M的质量要少一些,即消耗N的质量一定大于M的质量,故D错误;
故选:C.
点评:本题难度较大,主要考查了金属的化学性质、金属活动性顺序的应用及有关的计算,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
2010年世界环境日的中国主题:“低碳减排?绿色生活”.下列做法或认识不符合这一主题的是( )
| A、将使用后的废旧电池集中起来,统一处理 |
| B、植树造林,严禁乱砍滥伐 |
| C、燃烧垃圾清洁城市 |
| D、提倡乘坐公共交通、骑自行车或步行的方式出行 |
某微粒含有10个电子,下列说法正确的是( )
| A、一定含有10个质子 |
| B、一定是氖原子 |
| C、一定不能失去电子 |
| D、不能确定该微粒的名称 |
生活中常常会发生一些变化,下列变化不属于化学变化的是( )
| A、敞放的固体烧碱质量增加 |
| B、吃进的食物一段时间后被消化了 |
| C、樟脑球在衣柜中渐渐消失 |
| D、鸡蛋变臭 露天堆放的生石灰 |
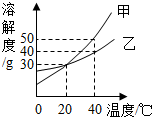 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )| A、40℃时,将甲、乙物质的溶液同时降温至20℃,所得溶液中溶质质量分数相等 |
| B、20℃时,100g甲的饱和溶液中溶质质量是30g |
| C、降低温度可使接近饱和的甲溶液变成饱和溶液 |
| D、40℃时,甲溶液的溶质质量分数大于乙溶液的溶质质量分数 |
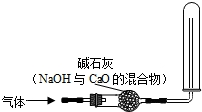 以下几种气体,不能用如图装置干燥并收集的是( )
以下几种气体,不能用如图装置干燥并收集的是( )①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥HCl.
| A、①② | B、①⑤ |
| C、①③④ | D、②③④⑥ |
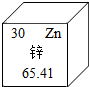 锌元素与人体健康有着千丝万缕的联系,影响着我们众多功能的运行与维护,有“生命之花”的美称.下列说法正确的是( )
锌元素与人体健康有着千丝万缕的联系,影响着我们众多功能的运行与维护,有“生命之花”的美称.下列说法正确的是( )| A、锌元素在人体中含量越多越好 |
| B、锌元素的相对原子质量为65.41克 |
| C、锌元素的质子数为30 |
| D、锌元素属于非金属元素 |