题目内容
 质量守恒定律对科学发展具有重大意义.
质量守恒定律对科学发展具有重大意义.
(1)由质量守恒定律可知,化学反应前后一定不变的是________(填序号).
①原子种类 ②原子数目 ③分子种类 ④分子数目
⑤元素种类 ⑥物质种类
(2)如图是某反应的微观示意图(其中“ ”和“
”和“ ”分别表示不同的原子)
”分别表示不同的原子)
①反应后方框内应再填入________个“ ”微粒.
”微粒.
②请从微观的角度分析化学变化的实质是________.
(3)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应.其中A、B、C的微观示意图和反应前后各物质的质量如下表所示.
| 物质 | A | B | C | D |  |
微观示意图 |  |  |  | ||
| 反应前质量/g | 100 | 1 | 1 | 46 | |
| 反应后质量/g | 4 | 89 | 55 | X |
②若D的相对分子质量为46,该反应的化学方程式是________.
解:(1)由质量守恒定律可知,化学反应前后一定不变的是原子的种类、数目,元素的种类不变;
(2)①由质量守恒定律反应前后原子的种类及数目不变可知,反应后方框内应生成8个 微粒,现已有了6个,应再添加2个
微粒,现已有了6个,应再添加2个 .
.
②由反应的微观示意图中微粒的变化可知化学变化的实质是:反应物的原子再重新组合成新物质的分子过程;
(3)①由质量守恒定律及由表中数据可知:二氧化碳的质量增加了89g-1g=88g,可确定二氧化碳是生成物;水蒸气的质量增加了55g-1g=54g,可确定水蒸气是生成物;氧气的质量减少了100g-4g=96g<88g+54g,可确定氧气和D都是反应物.D减少的质量为:88g+54g-96g=46g,因此X的值为:46-46=0.
②因反应物中的氧气里只含氧元素,因此生成物中的碳元素和氢元素一定来自D,即D中一定含有碳、氢两元素,生成物中氧元素的质量为88g×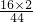 +54g×
+54g×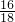 =112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为:
=112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为: :
: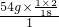 :
: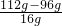 =2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:C2H6O+3O2
=2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:C2H6O+3O2 2CO2+3H2O.
2CO2+3H2O.
故答为:(1)①②⑤;(2)①2,②反应物的原子再重新组合成新物质的分子过程;(3)0,C2H6O+3O2 2CO2+3H2O.
2CO2+3H2O.
分析:(1)根据质量守恒定律进行分析;
(2)①根据质量守恒定律反应前后原子的种类及数目不变分析;
②根据反应的微观示意图中微粒的变化分析化学变化的实质;
(3)①根据质量守恒定律,由物质质量的增减量可确定反应物和生成物的质量,从而得出X的值;
②根据物质中元素的质量可确定构成物质的原子个数比,从而得到物质的化学式,根据化学方程式的书写步骤可写出该反应的化学方程式.
点评:此题是有关质量守恒定律的考查,解题的关键是理解该定律的宏观及微观含义,是一道考查较为全面的有关质量守恒定律的好题.
(2)①由质量守恒定律反应前后原子的种类及数目不变可知,反应后方框内应生成8个
 微粒,现已有了6个,应再添加2个
微粒,现已有了6个,应再添加2个 .
.②由反应的微观示意图中微粒的变化可知化学变化的实质是:反应物的原子再重新组合成新物质的分子过程;
(3)①由质量守恒定律及由表中数据可知:二氧化碳的质量增加了89g-1g=88g,可确定二氧化碳是生成物;水蒸气的质量增加了55g-1g=54g,可确定水蒸气是生成物;氧气的质量减少了100g-4g=96g<88g+54g,可确定氧气和D都是反应物.D减少的质量为:88g+54g-96g=46g,因此X的值为:46-46=0.
②因反应物中的氧气里只含氧元素,因此生成物中的碳元素和氢元素一定来自D,即D中一定含有碳、氢两元素,生成物中氧元素的质量为88g×
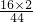 +54g×
+54g×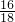 =112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为:
=112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为: :
: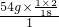 :
: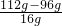 =2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:C2H6O+3O2
=2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:C2H6O+3O2 2CO2+3H2O.
2CO2+3H2O.故答为:(1)①②⑤;(2)①2,②反应物的原子再重新组合成新物质的分子过程;(3)0,C2H6O+3O2
 2CO2+3H2O.
2CO2+3H2O.分析:(1)根据质量守恒定律进行分析;
(2)①根据质量守恒定律反应前后原子的种类及数目不变分析;
②根据反应的微观示意图中微粒的变化分析化学变化的实质;
(3)①根据质量守恒定律,由物质质量的增减量可确定反应物和生成物的质量,从而得出X的值;
②根据物质中元素的质量可确定构成物质的原子个数比,从而得到物质的化学式,根据化学方程式的书写步骤可写出该反应的化学方程式.
点评:此题是有关质量守恒定律的考查,解题的关键是理解该定律的宏观及微观含义,是一道考查较为全面的有关质量守恒定律的好题.

练习册系列答案
相关题目
 2010年,云南省遭遇了百年一遇的旱情,给工农业生产和生活用水带来了严重困难.为缓解旱情,有关部门实施了人工降雨.李斌同学利用所学知识将浑浊的水用右图所示的简易净水器进行净化,请根据你掌握的知识回答:
2010年,云南省遭遇了百年一遇的旱情,给工农业生产和生活用水带来了严重困难.为缓解旱情,有关部门实施了人工降雨.李斌同学利用所学知识将浑浊的水用右图所示的简易净水器进行净化,请根据你掌握的知识回答: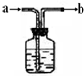 如图是化学实验中常被称为“万能瓶”的装置.
如图是化学实验中常被称为“万能瓶”的装置.