题目内容
【题目】水是一种重要的资源,爱护水资源,人人有责。
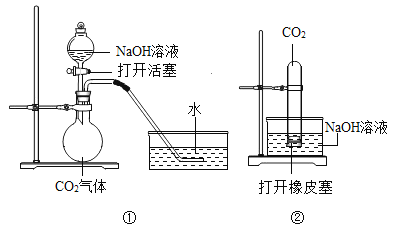
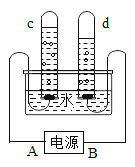
(1)如图所示,电解水的实验中,通电一段时间后,试管d中收集到的气体是_____,通过实验可以得出水是由_____组成的。
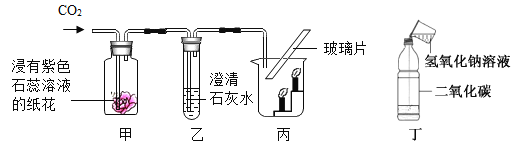
(2)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如图所示。
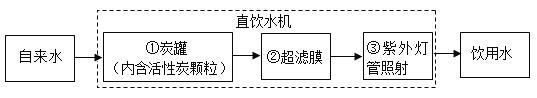
其中活性炭对应的作用是_____。
(3)日常生活中,常用_____区分硬水和软水,实现硬水软化的简单方法是_____。
(4)2018年世界环境日的主题是“美丽中国,我是行动者”,为打好污染防治攻坚战,我们采取了一系列应对措施,请写出防治水体污染的一条措施_____。
【答案】H2(或氢气) 氢元素和氧元素 吸附杂质 肥皂水 煮沸 工业废水经过处理达标后才能排放(合理即可)
【解析】
(1)如图所示,电解水的实验中,通电一段时间后,正极产生氧气,体积小,负极产生氢气,体积大;试管d中产生的气体体积大是氢气,通过实验可以得出水是由氢氧两种元素组成的。
(2)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如图所示。
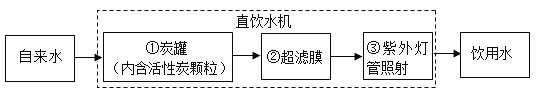
其中活性炭(具有疏松多孔状结构)对应的作用是:吸附色素和异味;
(3)日常生活中,常用肥皂水区分硬水和软水,混合搅拌后,浮渣多,泡沫少的是硬水,反之是软水;实现硬水软化的简单方法是加热、煮沸;煮沸过程中钙离子和镁离子都成形成沉淀,降低水的硬度;
(4)为打好污染防治攻坚战,我们采取了一系列应对措施,防治水体污染的一条措施:工业废水经过处理达标后才能排放。

【题目】小明通过阅读《科学的历程》知道质量守恒定律的发现经历了漫长、曲折的过程。
历程与思考
历程一:早在1663年,英国化学家波义耳将金属汞放在密闭容器里煅烧,打开容器盖冷却后称量,得出的结论是物质的总质量增加了,导致波义耳与质量守恒定律失之交臂你认为质量增大的原因是_____。
历程二:1756年,俄国化学家罗蒙诺索素夫将金属锡放在密闭容器里煅烧,发现总质量和煅烧前没有变化。
历程三:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,得到了与罗蒙诺索夫相同的结论,从而总结出了质量守恒定律。拉瓦锡还通过这个实验研究了_____,成就了化学史上的另一经典实验。
验证与拓展
为了验证科学家们发现的质量守恒定律,小明设计了如图所示的三个实验,
(实验步骤)
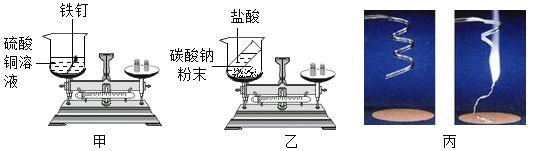
如图所示,甲、乙实验,用砝码使天平平衡后,随即使其发生反应,丙实验对石棉网和打磨干净的镁条进行反应前后的称量。三组实验小明都进行了规范的操作以及准确的称量和认真观察。请完成下表内容。
实验 | 实验现象 | 反应化学方程式 |
甲 | _____ |
|
乙 | _____ | _____ |
丙 | _____ | _____ |
(实验分析)通过对上述实验的对比分析,小明认为实验甲遵守质量守恒定律,而实验乙和丙不遵守质量守恒。小组同学认为小明这种说法不正确,请分析导致实验乙和丙反应前后称量质量不相等的原因_____。
(实验结论)化学反应都遵守质量守恒定律。
请从微观的角度分析化学反应遵循质量守恒的原因是_____。
(实验拓展)小明查阅资料发现,实验甲得到的铜在工业上能与氯化铜溶液和盐酸在50℃时反应制作电路,生成物经处理又能转化为氯化铜。反应如下:
①![]() ;②
;②![]() ;③
;③![]()
(1)反应②中X的化学式为_____。
(2)反应①中氯化铜的质量_____(填“=”或“<”或“>”)反应③中氯化铜的质量。
(3)反应①结束后,进行蒸发操作得到固体的质量为10.66g,其中铜元素的质量为6.4g该固体的成分为_____。
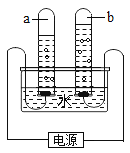
【题目】某兴趣小组活动中,同学们按图1装置对“可燃物燃烧的条件”进行探究。探究过程中,大家对磷燃烧生成的大量白烟是否危害人体健康提出疑问。
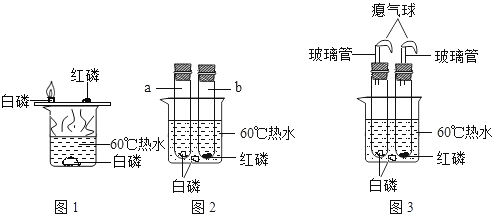
(查阅资料)白磷的着火点是40℃,红磷的着火点是240℃,燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,五氧化二磷能与空气中水蒸气反应,生成有毒的偏磷酸(HPO3),该反应的化学方程式为____________________。
(交流与讨论)白烟对人体健康有害,该实验装置必须改进。
(改进与实验)同学们按改进后的图2装置进行实验。请你帮助他们将下表补充完整。
现象 | 解释 |
①a试管中的白磷燃烧 ②烧杯中的白磷、b试管中的红磷没有燃烧 | 烧杯中的白磷、b试管中的红磷没有燃烧的原因分别是:①_________;②___________。 |
(反思与评价)
(1)改进后的图2装置与图1装置比较,优点是__________。
(2)小林同学指出图2装置仍有不足之处,并设计了图3装置,其中气球的作用是___________,欲使图3装置中的红磷着火,可将试管从水中取出并__________后对试管加热。