题目内容
(2010·甘肃兰州,38)实验室有一瓶存放时间过长的氢氧化钠,其中一部分已转化成为了碳酸钠。现需用该药品配制氢氧化钠溶液。取50克该药品,溶于200mL水中(水的密度为1g/cm3),然后慢慢地滴加7.4%的澄清石灰水,当用去100克澄清石灰水时,碳酸钠恰好反应完全。
计算:(1)50克该药品中碳酸钠的质量;
(2)滤出沉淀后所得溶液的溶质质量分数。(精确到0.01%)
【答案】
(共7分)
解:设50克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成CaCO3的质量为z。
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
106 74 100 80
x 100×7.4% z y
x =10.6 y=8 z =10 2分
 (1)50克该药品中碳酸钠的质量为10.6g 1分
(1)50克该药品中碳酸钠的质量为10.6g 1分
(2)溶液中溶质NaOH的质量= 8 +(50-10.6)= 47.4g(1分)
溶液的总质量 = 50+200+100-10=340g(1分)
反应后溶液中溶质的质量分数=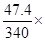 100%==13.94%(1分)
100%==13.94%(1分)
答:50克该药品中碳酸钠的质量为10.6g,反应后生成的溶液中溶质的质量分数为13.94%(注:方程式书写正确解、设、答完整得1分)
【解析】略

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目