题目内容
金属在日常生活中随处可见,研究金属的性质可以更好地利用金属。
(1)铝、铁、铜是常见金属.下列生活用品中,主要利用金属导热性的是 (填序号)。

(2)下列汽车配件及用品中,属于合金的是 (填序号)。

(3)汽车在喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,反应的化学方程式是 ; 。
(4)取一定量镁、锌、铁三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等,下列做法能达到上述结果的是 (填序号)。
(1)铝、铁、铜是常见金属.下列生活用品中,主要利用金属导热性的是 (填序号)。

(2)下列汽车配件及用品中,属于合金的是 (填序号)。

(3)汽车在喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,反应的化学方程式是 ; 。
(4)取一定量镁、锌、铁三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等,下列做法能达到上述结果的是 (填序号)。
| A.相同质量的三种金属与足量的稀盐酸反应 |
| B.2.4g镁、6.5g锌、5.6g铁与足量的稀盐酸反应 |
| C.向足量的镁、锌、铁中加入稀盐酸的质量比为2:2:3 |
| D.足量的三种金属与等量的稀盐酸反应. |
(1)②;(2)A;(3)Fe2O3+6HCl═2FeCl3+3H2O; Fe+2HCl═FeCl2+H2↑;(4)BD
试题分析:(1)物质的结构决定物质的性质,物质的性质决定物质的用途。用铜制成各种炊具,是利用它的良好的导热性;故答案为:②;
(2)根据合金的判断方法考虑。钢铁是铁的合金,玻璃是硅酸盐材料,橡胶轮胎属于合成材料,羊毛属于天然材料;
(3)盐酸除锈的反应物是氧化铁和盐酸写在等号的前边,生成物是氯化铁和水写在等号的右边,用观察法配平即可,所以方程式是:Fe2O3+6HCl═2FeCl3+3H2O;把铁锈反应掉,盐酸继续与铁反应,反应物是铁和盐酸,生成物是氯化亚铁和氢气,用观察法配平,氢气后面标上上升符号,所以方程式是:Fe+2HCl═FeCl2+H2↑;
(4)A、相同质量的三种金属与足量的稀盐酸反应时,镁产生氢气最多,锌产生氢气最少,故A错;
B、假设Fe、Mg、Zn 三种金属分别跟稀盐酸充分反应,得到氢气的质量都是2g,设参与反应的Fe的质量为x,Mg的质量为y,Zn的质量为z,则
Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,Zn+2HCl=ZnCl2+H2↑
56 2 24 2 65 2
x 2g y 2g z 2g
根据
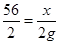 ,解之得:x=56g;根据
,解之得:x=56g;根据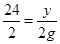 ,解得y=24g;根据
,解得y=24g;根据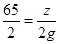 ,解得z=65g,故Mg、Zn、Fe的质量比为:24g:65g:56g=24:65:56,因此B正确;C、由于产生的氢气是盐酸中的氢离子,消耗的盐酸不相同,产生的氢气也是不相同的,故C错;D、因为产生氢气的是盐酸中的氢离子,故参与反应的HCl的质量相等,产生的氢气的质量就相等,故D正确,故选BD。
,解得z=65g,故Mg、Zn、Fe的质量比为:24g:65g:56g=24:65:56,因此B正确;C、由于产生的氢气是盐酸中的氢离子,消耗的盐酸不相同,产生的氢气也是不相同的,故C错;D、因为产生氢气的是盐酸中的氢离子,故参与反应的HCl的质量相等,产生的氢气的质量就相等,故D正确,故选BD。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目