题目内容
(2004?广州)实验室常用一定质量分数的过氧化氢溶液制取氧气.某同学实验前称得一定质量分数的过氧化氢溶液42.5g,加入1gMnO2,完全反应后称得剩余物的质量为41.9g.计算:
(1)反应中放出氧气的质量.
(2)实验中加入的过氧化氢溶液的质量分数.
(1)反应中放出氧气的质量.
(2)实验中加入的过氧化氢溶液的质量分数.
分析:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故完全反应后称得剩余物质减少的质量就是生成气体的质量.(二氧化锰只是催化剂,不参与反应)
(2)根据过氧化氢分解反应的化学方程式和生成气体的质量,即可计算出实验中参加反应的过氧化氢的质量,进一步可求得过氧化氢溶液的质量分数.
(2)根据过氧化氢分解反应的化学方程式和生成气体的质量,即可计算出实验中参加反应的过氧化氢的质量,进一步可求得过氧化氢溶液的质量分数.
解答:解:(1)放出02的质量为:42.5g+1g-41.9 g=1.6g
(2)设参加反应的过氧化氢的质量为x
2H2O2
2H2O+O2↑
68 32
x 1.6g
=
x=3.4g
过氯化氢溶液的质量分数为
×100%=8%
答:反应中放出02的质量为1.6 g,原过氧化氢溶液的质量分数为8%.
(2)设参加反应的过氧化氢的质量为x
2H2O2
| ||
68 32
x 1.6g
| 68 |
| x |
| 32 |
| 1.6g |
x=3.4g
过氯化氢溶液的质量分数为
| 3.4g |
| 42.5g |
答:反应中放出02的质量为1.6 g,原过氧化氢溶液的质量分数为8%.
点评:本题主要考查学生利用化学方程式进行计算的能力.

练习册系列答案
相关题目
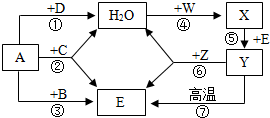 (2004?广州)A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,它们之间能发生如下变化,其中变化⑥是实验室制备E的常用方法(图中略去部分反应的产物).
(2004?广州)A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,它们之间能发生如下变化,其中变化⑥是实验室制备E的常用方法(图中略去部分反应的产物). (2004?广州)实验室利用如图所示 装置进行加热高锰酸钾制氧气的实验.
(2004?广州)实验室利用如图所示 装置进行加热高锰酸钾制氧气的实验.