题目内容
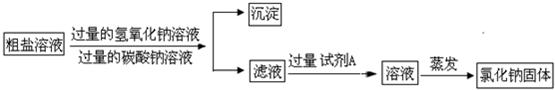
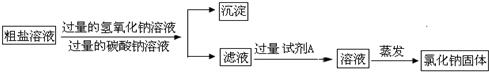
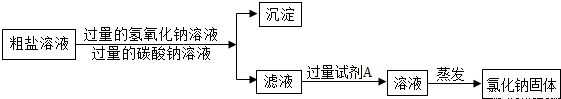
实验室有一包含有少量MgCl2和 CaCl2的粗盐,某小组同学要得到纯净的氯化钠固体,进行了如下实验.请回答相关问题:(1)第一步将粗盐加水溶解,向其中加入过量的氢氧化钠溶液并搅拌,产生白色沉淀.目的是为了除去______.某同学提出:“如果把氢氧化钠溶液换成氢氧化钾溶液,行不行?”小组同学经讨论,一致认为不可行.理由是______.
(2)第二步向上述液体中再加入过量的碳酸钠溶液并搅拌,产生白色沉淀.发生反应的化学方程式为______.
(3)第三步过滤.过滤得到的固体沉淀物是______(填化学式)
(4)第四步向滤液中加入过量的试剂A的目的是:______.
(5)第五步将溶液蒸发结晶得到氯化钠固体.
【答案】分析:粗盐中含有的少量MgCl2和 CaCl2分别能与氢氧化钠、碳酸钠反应生成氢氧化镁和碳酸钙沉淀,同时生成氯化钠;通过向粗盐溶液中加入过量的氢氧化钠溶液、碳酸钠溶液,充分反应后过滤,可除去粗盐中的少量MgCl2和 CaCl2杂质,而过量的氢氧化钠和碳酸钠又可以通过加入过量稀盐酸的方法除去,同时又生成氯化钠;而过量的稀盐酸在蒸发过程中挥发,结晶析出较为纯净的氯化钠晶体;
解答:解:(1)利用MgCl2能与氢氧化钠生成氢氧化镁沉淀和氯化钠,因此,加入过量氢氧化钠以确保完全除去粗盐中的MgCl2;如果使用氢氧化钾虽然也可以生成氢氧化镁沉淀而除去MgCl2杂质,但生成的氯化钾会使所得氯化钠不纯,即引入了新的杂质;
故答案为:MgCl2;会有氯化钾新杂质生成;
(2)碳酸钠与CaCl2通过相互交换成分,生成碳酸钙沉淀和氯化钠;
故答案为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(3)加入过量的氢氧化钠溶液、碳酸钠溶液,充分反应后过滤,所得固体为反应后生成的氢氧化镁和碳酸钙沉淀;
故答案为:Mg(OH)2和CaCO3;
(4)为确保除去前面所加入的过量的氢氧化钠溶液、碳酸钠溶液,需要加入过量的稀盐酸;
故答案为:除去过量的氢氧化钠和碳酸钠溶液.
点评:根据氯化钠与氯化镁、氯化钙性质的不同,使用恰当的试剂可除去混在氯化钠中的可溶性杂质,达到提纯粗盐的目的.
解答:解:(1)利用MgCl2能与氢氧化钠生成氢氧化镁沉淀和氯化钠,因此,加入过量氢氧化钠以确保完全除去粗盐中的MgCl2;如果使用氢氧化钾虽然也可以生成氢氧化镁沉淀而除去MgCl2杂质,但生成的氯化钾会使所得氯化钠不纯,即引入了新的杂质;
故答案为:MgCl2;会有氯化钾新杂质生成;
(2)碳酸钠与CaCl2通过相互交换成分,生成碳酸钙沉淀和氯化钠;
故答案为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(3)加入过量的氢氧化钠溶液、碳酸钠溶液,充分反应后过滤,所得固体为反应后生成的氢氧化镁和碳酸钙沉淀;
故答案为:Mg(OH)2和CaCO3;
(4)为确保除去前面所加入的过量的氢氧化钠溶液、碳酸钠溶液,需要加入过量的稀盐酸;
故答案为:除去过量的氢氧化钠和碳酸钠溶液.
点评:根据氯化钠与氯化镁、氯化钙性质的不同,使用恰当的试剂可除去混在氯化钠中的可溶性杂质,达到提纯粗盐的目的.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目