题目内容
氢氧化钠与盐酸发生中和反应的化学方程式为
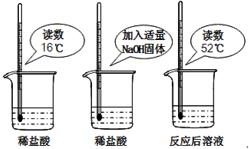
(1)为证明中和反应是放热反应,某小组进行了如如图所示的实验操作:根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是
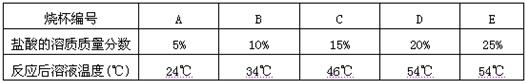
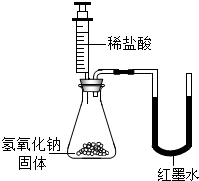
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
【实验结论】影响中和反应放出热量多少的因素是
【交流反思】反应后,烧杯内溶液pH最小的是
NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
(2分).(1)为证明中和反应是放热反应,某小组进行了如如图所示的实验操作:根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是
氢氧化钠固体溶于水也会放出大量的热
氢氧化钠固体溶于水也会放出大量的热
.
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:

【实验结论】影响中和反应放出热量多少的因素是
反应物的浓度
反应物的浓度
.【交流反思】反应后,烧杯内溶液pH最小的是
E
E
(2分,填烧杯编号).分析:根据反应物、生成物以及反应原理书写化学方程式.
(1)根据氢氧化钠溶于水也会放热进行分析,
(2)【实验结论】根据表中的数据进行分析,
【交流反思】根据氢氧化钠和盐酸反应中的比例关系进行分析.
(1)根据氢氧化钠溶于水也会放热进行分析,
(2)【实验结论】根据表中的数据进行分析,
【交流反思】根据氢氧化钠和盐酸反应中的比例关系进行分析.
解答:解:氢氧化钠和盐酸发生中和反应生成氯化钠和水,故答案为:NaOH+HCl═NaCl+H2O,
(1)稀盐酸在没有加入氢氧化钠前的温度时16℃,加入氢氧化钠反应后,温度变成了52℃,溶液的温度虽然升高了,但是氢氧化钠溶于水也要放热,是中和反应的热量还是氢氧化钠溶于水的热量,故答案为:氢氧化钠固体溶于水也会放出大量的热,
(2)【实验结论】从A到E盐酸的质量分数逐渐的增大,加入相同的氢氧化钠后,从A到E溶液温度的改变也是由小到大,故答案为:反应物的浓度,
交流反思 加入的纯净的氢氧化钠是相同的,
A中盐酸的溶质:36.5×5%,
B中的溶质:36.5×10%,
C中的溶质:36.5×15%,
D中的溶质:36.5×20%,
E中的溶质:36.5×25%,
根据比较可知,E中盐酸的溶质最多,中和时消耗的氢氧化钠最多,现在氢氧化钠的质量相同,根据计算
NaOH+HCl═NaCl+H2O
40 36.5
40×20% 36.5×20%
可知D中的恰好完全反应,A、B中氢氧化钠有剩余,E中的盐酸有剩余,故答案为:E.
(1)稀盐酸在没有加入氢氧化钠前的温度时16℃,加入氢氧化钠反应后,温度变成了52℃,溶液的温度虽然升高了,但是氢氧化钠溶于水也要放热,是中和反应的热量还是氢氧化钠溶于水的热量,故答案为:氢氧化钠固体溶于水也会放出大量的热,
(2)【实验结论】从A到E盐酸的质量分数逐渐的增大,加入相同的氢氧化钠后,从A到E溶液温度的改变也是由小到大,故答案为:反应物的浓度,
交流反思 加入的纯净的氢氧化钠是相同的,
A中盐酸的溶质:36.5×5%,
B中的溶质:36.5×10%,
C中的溶质:36.5×15%,
D中的溶质:36.5×20%,
E中的溶质:36.5×25%,
根据比较可知,E中盐酸的溶质最多,中和时消耗的氢氧化钠最多,现在氢氧化钠的质量相同,根据计算
NaOH+HCl═NaCl+H2O
40 36.5
40×20% 36.5×20%
可知D中的恰好完全反应,A、B中氢氧化钠有剩余,E中的盐酸有剩余,故答案为:E.
点评:本题主要从不同的方面对中和反应进行了研究,注意了应用数据进行论证.

练习册系列答案
相关题目
 27、氢氧化钠与盐酸发生中和反应的化学方程式为
27、氢氧化钠与盐酸发生中和反应的化学方程式为
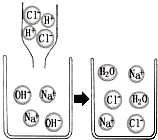 如图是氢氧化钠与盐酸发生复分解反应的微观粒子示意图,同时我们已知道复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.结合信息、图示,你认为下列各组离子间不能反应的是( )
如图是氢氧化钠与盐酸发生复分解反应的微观粒子示意图,同时我们已知道复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.结合信息、图示,你认为下列各组离子间不能反应的是( )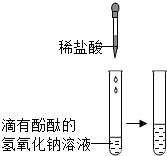
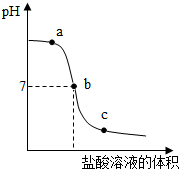 (2012?盐城一模)向氢氧化钠溶液中不断滴入盐酸,得到如下曲线,下列有关判断正确的是( )
(2012?盐城一模)向氢氧化钠溶液中不断滴入盐酸,得到如下曲线,下列有关判断正确的是( )