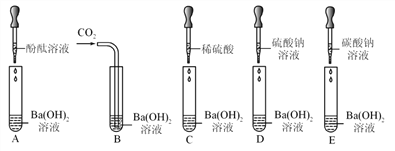
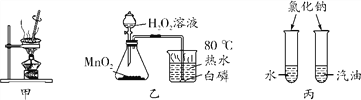
题目内容
【题目】构建知识网络是学习化学的常用方法,A~G 都是初中化学中常见的物质,已知 A、B、C、 D、G 是不同类别的物质,A 俗称烧碱,D 溶液中有蓝色的硫酸盐,B 是光合作用的原料,E 为红色粉末.它们之间的转化关系如图所示.(图中“-”表示反应,“→”表示转化关系) 请回答下列问题:

(1)请写出化学式:D__,E__,F__。
(2)按物质分类,C 属于__(选填“氧化物”“酸”“碱”或“盐”);C 与 A 反应的 化学方程式为____。
(3)物质的性质决定用途,F 具有还原性,可作还原剂,请写出 F 的另一种用途:__。
(4)若 A 溶液能使指示剂变成红色,则选用的指示剂为__(选填“紫色 石蕊”或“无色酚酞”)溶液.
【答案】 (1)CuSO4 (2)Fe2O3 (3)CO (4)酸 (5)NaOH + HCl = NaCl + H2O (6)燃料 (7)无色酚酞
【解析】(1)A~G都是初中化学中常见的物质,A、B、C、D、G是不同类别的物质,A俗称烧碱,所以A是氢氧化钠,D溶液中有蓝色的硫酸盐,所以D是硫酸铜,B是光合作用的原料,B会与氢氧化钠反应,所以B是二氧化碳,E为红色粉末,C会与氢氧化钠、E反应,所以C是盐酸,E是氧化铁,F是一氧化碳,G会与硫酸铜反应,一氧化碳和氧化铁反应生成铁和二氧化碳,所以G是铁,经过验证,推导正确,所以D是CuSO4,E是Fe2O3,F是CO;(2)通过推导可知,C是盐酸,按物质分类,C属于酸;C与A的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:HCl+NaOH=NaCl+H2O;(3)物质的性质决定用途,F具有还原性,可作还原剂,F的另一种用途是做燃料;(4)若氢氧化钠溶液能使指示剂变成红色,则选用的指示剂为无色酚酞溶液。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:
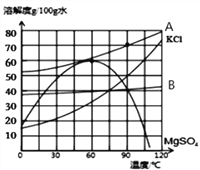
(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示 MgCl2溶解度曲线的是_________。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为_______(请写出计算表达式即可)
②四种盐中溶解度受温度变化的影响最小的 是___________。(填化学式)
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的方法是_____________。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液):
实验序号 | 反应温度/℃ | 反应时间/min | 反应pH值 | Mg2+的沉淀率/% |
a | 40 | 60 | 10 | 90.1 |
b | 40 | 60 | 12 | 92.7 |
c | 40 | 90 | 12 | 93.6 |
d | 50 | 60 | 12 | 96.4 |
e | 50 | 90 | 12 | x |
①反应过程中需测定溶液的pH,则测定溶液pH的操作是:先在玻璃片上放一小片pH试纸,然后用_____________,再将试纸显示的颜色与标准比色卡比较,读取溶液的pH。
②实验a和b对比,可得到的结论是___________________。
③表格中X的数值可能为__________(填编号)。
A.95.8 B.92.1 C.97.2 D.93.1
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
【阅读资料】
①H2 与钙加热可制得 CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体 ;
【实验探究】 设计的制取装置如下图所示:
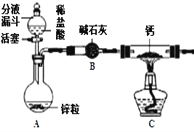
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置 B 的作用是;根据完整的实验装置进 行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后实验步骤正_____ 确的顺序标号是___ (A.加热反应一段时间;B.收集装置右端导管口处的气体并检验 其纯度;C.关闭分液漏斗活塞;D.停止加热,充分冷却)。
(2)制备 CaH2 实验结束后,取少量产物,小心加入水中,观察到有气泡产生,在溶液中滴入石 蕊试液后显_____色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一 定正确,原因____。
(3)取少量上述制得的 CaH2 样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液, 经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将燃烧产物通入澄清石灰水中,无现象,则该气体为___(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验: 猜想一:NaOH 猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2 经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因_______
【实验验证】
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3 溶液 | ________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________ | 猜想三成立 |
【定量分析】
取制得的 CaH2 样品 ag(已知样品中只含两种元素,CaH2 的质量分数为 84%),加到足量的 Na2CO3溶液中,充分反应后得 24gCaCO3,则 a 的值为_________(写出计算过程)