题目内容
某研究小组的同学将洁净的铁钉投入到氯化铜溶液中,发现铁钉表面生成红色固体物质的同时有较多气泡产生,生成的是什么气体呢?
(1)【提出猜想】从物质的组成元素角度分析,研究小组的同学猜想产生的气体可能是HCl、Cl2.甲同学猜想生成的气体可能是氧气,假如产生的气体是O2,则检验氧气的方法是 .乙同学猜想生成的气体还可能是 (填化学式).
(2)【查阅资料】25℃时:HCl气体在水中的溶解度是500,极易溶于水;Cl2在水中的溶解度约是2,能溶于水,它能与NaOH溶液发生化学反应.丙同学根据查阅到的资料推理得出产生的气体不可能是上述猜想中的
(3)【验证猜想】丁同学认为可用实验来证明产生的气体是Cl2,方法是将产生的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量进行检验.Cl2与NaOH溶液反应的化学方程式是:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式为 ;生成物NaClO中氯元素的化合价为 .
(4)【设计方案】研究小组的同学合作设计了如图的实验方案,排除和验证猜想的气体.
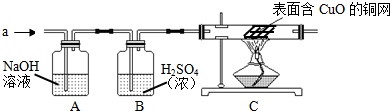
如果产生的气体是氧气和氢气,则装置C中存在的安全隐患是 .现在产生的气体经研究小组同学的安全确认后,同学们首先对装置A进行称量,再将收集到的干燥的气体从a处通入,过一会儿点燃C处的酒精灯,一段时间后,发现表面含CuO的铜网变为光亮的红色;停止通气,再称量装置A,发现质量无增减.由此可知:铁钉与氯化铜溶液反应时,产生的气体是与乙同学的猜想是相同的.上述含CuO的铜网变为光亮的红色时发生的化学反应方程式是 .
(5)【实验反思】装置B中浓H2SO4起干燥作用,通常可用来干燥 气体(要求写出两种气体).由上述实验可以推出氯化铜溶液的呈 (选填“酸性”、“碱性”或“中性”).
(1)【提出猜想】从物质的组成元素角度分析,研究小组的同学猜想产生的气体可能是HCl、Cl2.甲同学猜想生成的气体可能是氧气,假如产生的气体是O2,则检验氧气的方法是
(2)【查阅资料】25℃时:HCl气体在水中的溶解度是500,极易溶于水;Cl2在水中的溶解度约是2,能溶于水,它能与NaOH溶液发生化学反应.丙同学根据查阅到的资料推理得出产生的气体不可能是上述猜想中的
(3)【验证猜想】丁同学认为可用实验来证明产生的气体是Cl2,方法是将产生的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量进行检验.Cl2与NaOH溶液反应的化学方程式是:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式为
(4)【设计方案】研究小组的同学合作设计了如图的实验方案,排除和验证猜想的气体.

如果产生的气体是氧气和氢气,则装置C中存在的安全隐患是
(5)【实验反思】装置B中浓H2SO4起干燥作用,通常可用来干燥
考点:实验探究物质的性质或变化规律,常见气体的检验与除杂方法,氧气的检验和验满,金属的化学性质,有关元素化合价的计算,质量守恒定律及其应用
专题:科学探究
分析:(1)根据氧气的助燃性回答;根据物质中所含元素回答.
(2)根据氯化氢的溶解性回答.
(3)根据质量守恒定律的元素守恒、反应前后原子的种类和数目不变,进行回答.根据在化合物中,元素化合价的代数和为零进行解答.
(4)①根据可燃性的气体与氧气混合后点燃易发生爆炸回答.
②根据检验氢气纯度的方法回答.根据气体能与氧化铜在加热的条件下反应及反应现象回答.
(5)根据浓硫酸的吸水性回答.根据活泼金属与酸反应生成盐和氢气的性质回答.
(2)根据氯化氢的溶解性回答.
(3)根据质量守恒定律的元素守恒、反应前后原子的种类和数目不变,进行回答.根据在化合物中,元素化合价的代数和为零进行解答.
(4)①根据可燃性的气体与氧气混合后点燃易发生爆炸回答.
②根据检验氢气纯度的方法回答.根据气体能与氧化铜在加热的条件下反应及反应现象回答.
(5)根据浓硫酸的吸水性回答.根据活泼金属与酸反应生成盐和氢气的性质回答.
解答:解:
(1)氧气有助燃性,可用带火星的木条检验,看是否复燃.根据质量守恒定律的元素守恒,“铁钉投入到氯化铜溶液”中的元素有铁、氯、铜、氢、氧元素,故乙同学猜想生成的气体还可能是H2;
(2)HCl气体在水中的溶解度是500,极易溶于水,如产生的气体是氯化氢,它不会从溶液中释放出来.
(3)根据质量守恒定律和Cl2与NaOH溶液反应的化学方程式Cl2+2NaOH=NaCl+NaClO+X,利用反应前后原子的种类和数目不变,反应前Cl原子2个,Na、O、H原子各2个;反应后Na、Cl原子各2个,O原子1个,则X中含有H原子2个、O原子1个,故X的化学式是H2O.
NaClO中,钠元素的化合价是+1价,氧元素的化合价是-2价,设Cl元素的化合价为x,则(+1)+x+(-2)=0,则x=+1价.
(4)①因为可燃性的气体与氧气混合后点燃易发生爆炸,故如果产生的气体是O2和H2,存在爆炸的安全隐患.
②将收集到的干燥的气体从a处通入,过一会儿点燃C处的酒精灯,过一段时间后,发现表面含CuO的铜网变为光亮的红色,说明气体具有还原性;根据题目中信息“Cl2在水中的溶解度约是2,能溶于水,它能与NaOH溶液发生化学反应”,故氢氧化物溶液能吸收氯气,而溶液质量增加,“停止通气,再称量装置A,发现质量无增减”,说明气体不是氯气.而“铁钉与氯化铜溶液反应时,产生的气体是与乙同学的猜想是相同的”,即生成的气体为氢气,故其反应的化学方程式为H2+CuO
Cu+H2O;
(5)浓硫酸有吸水性,可以干燥气体,如干燥氢气、氧气等气体.因为活泼金属能与酸反应生成盐和氢气,又由于此实验中产生的气体是氢气,所以氯化铜溶液显酸性.
故答案为:
(1)用带火星的木条检验,看是否复燃.H2;
(2)氯化氢.
(3)H2O.+1.
(4)①爆炸.②H2+CuO
Cu+H2O;
(5)氢气、氧气;酸.
(1)氧气有助燃性,可用带火星的木条检验,看是否复燃.根据质量守恒定律的元素守恒,“铁钉投入到氯化铜溶液”中的元素有铁、氯、铜、氢、氧元素,故乙同学猜想生成的气体还可能是H2;
(2)HCl气体在水中的溶解度是500,极易溶于水,如产生的气体是氯化氢,它不会从溶液中释放出来.
(3)根据质量守恒定律和Cl2与NaOH溶液反应的化学方程式Cl2+2NaOH=NaCl+NaClO+X,利用反应前后原子的种类和数目不变,反应前Cl原子2个,Na、O、H原子各2个;反应后Na、Cl原子各2个,O原子1个,则X中含有H原子2个、O原子1个,故X的化学式是H2O.
NaClO中,钠元素的化合价是+1价,氧元素的化合价是-2价,设Cl元素的化合价为x,则(+1)+x+(-2)=0,则x=+1价.
(4)①因为可燃性的气体与氧气混合后点燃易发生爆炸,故如果产生的气体是O2和H2,存在爆炸的安全隐患.
②将收集到的干燥的气体从a处通入,过一会儿点燃C处的酒精灯,过一段时间后,发现表面含CuO的铜网变为光亮的红色,说明气体具有还原性;根据题目中信息“Cl2在水中的溶解度约是2,能溶于水,它能与NaOH溶液发生化学反应”,故氢氧化物溶液能吸收氯气,而溶液质量增加,“停止通气,再称量装置A,发现质量无增减”,说明气体不是氯气.而“铁钉与氯化铜溶液反应时,产生的气体是与乙同学的猜想是相同的”,即生成的气体为氢气,故其反应的化学方程式为H2+CuO
| ||
(5)浓硫酸有吸水性,可以干燥气体,如干燥氢气、氧气等气体.因为活泼金属能与酸反应生成盐和氢气,又由于此实验中产生的气体是氢气,所以氯化铜溶液显酸性.
故答案为:
(1)用带火星的木条检验,看是否复燃.H2;
(2)氯化氢.
(3)H2O.+1.
(4)①爆炸.②H2+CuO
| ||
(5)氢气、氧气;酸.
点评:物质的推断是初中化学的难重点,也是中考的热点之一,了解物质的性质是解题的前提条件,解题时还要注意前后步骤间的联系,充分利用综合归纳法得出完整合理的结论.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列各组气体燃烧后只生成CO2的是( )
| A、H2 |
| B、CO |
| C、CH4 |
| D、H2和CO |
 人体中铁元素主要存在于血液中,是血红蛋白的成分,能帮助氧气的运输.如果体内缺铁会引起贫血.如图是某品牌补铁剂的药品标签.请回答:
人体中铁元素主要存在于血液中,是血红蛋白的成分,能帮助氧气的运输.如果体内缺铁会引起贫血.如图是某品牌补铁剂的药品标签.请回答: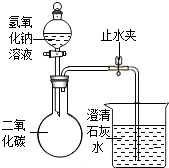 某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.
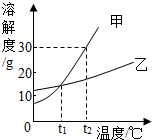 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.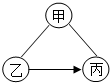 不同类别的物质间存在着一定的关系,碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质.)试判断:
不同类别的物质间存在着一定的关系,碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质.)试判断: