题目内容
下表是部分元素的原子结构示意图、主要化合价等信息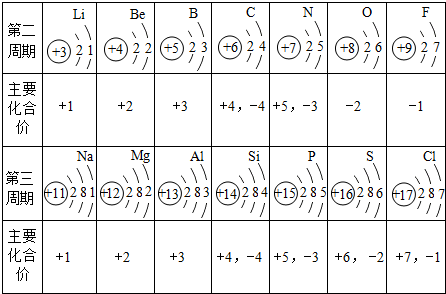
①表中不同种元素最本质的区别是
A.中子数不同;B.质子数不同;C.相对原子质量不同
②写出由原子序数为13和17的元素组成化合物的化学式
③上表中各元素的最高正化合价与原子最外层电子数的关系是
④镁元素属于

⑤右图形象地表示了某化学反应前后分子的变化.其中“
 ”表示原子序数为8的原子,“
”表示原子序数为8的原子,“ ”表示原子序数为6的原子,则该反应的化学方程式为:
”表示原子序数为6的原子,则该反应的化学方程式为:分析:①元素是质子数相同的同一类原子的总称,质子数决定元素的种类;
②原子序数13的元素铝呈+3价,原子序数17的氯元素呈+7和-1价,根据化合物中化合价代数和为零,氯元素与铝元素化合时应为-1价;
③根据表中原子结构中最外层电子数与元素最高正价的对比,可以发现最高正价与最外层电子数一致;
④最外层电子少于4,一般为金属元素,易失去电外层电子而形成带正电的阳离子;而最外层电子大于4表现出易得电子而使最外层达8电子稳定结构;元素的化学性质主要决定于最外层电子数,而同一纵行的元素的最外层电子数相等;
⑤原子序数为8的是氧元素、序数为6的是碳元素,结合反应的微观示意图,可以得出反应为CO在氧气中燃烧.
②原子序数13的元素铝呈+3价,原子序数17的氯元素呈+7和-1价,根据化合物中化合价代数和为零,氯元素与铝元素化合时应为-1价;
③根据表中原子结构中最外层电子数与元素最高正价的对比,可以发现最高正价与最外层电子数一致;
④最外层电子少于4,一般为金属元素,易失去电外层电子而形成带正电的阳离子;而最外层电子大于4表现出易得电子而使最外层达8电子稳定结构;元素的化学性质主要决定于最外层电子数,而同一纵行的元素的最外层电子数相等;
⑤原子序数为8的是氧元素、序数为6的是碳元素,结合反应的微观示意图,可以得出反应为CO在氧气中燃烧.
解答:解:①质子数决定元素的种类,所以,不同种元素最本质的区别是质子数;
故答案为:B;
②原子序数为13的是铝元素、序数为17的是氯元素,两元素化合时,铝为+3价、氯为-1价,所以,化合物的化学式为AlCl3;
故答案为:AlCl3;
③通过对比最高正价与最外层电子数,如氯元素最高正价为+7,而最外层电子数也为7,因此,可得出两者都相等的判断;
故答案为:相等;
④镁原子的最外层电子数为2,小于4,为金属元素,易失去电外层2个电子而成为带2个单位正电荷的镁离子,其符号为Mg2+;氟原子最外层电子数为7,大于4,易得电子;同一纵行的元素的最外层电子数相等,因此它们的化学性质相似;
故答案为:金属;Mg2+;得;相似;
⑤原子序数为8的是氧元素,原子序数为6的是碳元素,则反应物为一个碳原子和一个氧原子构成的CO分子、两个氧原子构成的O2分子;而生成物为2个由碳原子和氧原子构成的CO2分子;
故答案为:2CO+O2
2CO2.
故答案为:B;
②原子序数为13的是铝元素、序数为17的是氯元素,两元素化合时,铝为+3价、氯为-1价,所以,化合物的化学式为AlCl3;
故答案为:AlCl3;
③通过对比最高正价与最外层电子数,如氯元素最高正价为+7,而最外层电子数也为7,因此,可得出两者都相等的判断;
故答案为:相等;
④镁原子的最外层电子数为2,小于4,为金属元素,易失去电外层2个电子而成为带2个单位正电荷的镁离子,其符号为Mg2+;氟原子最外层电子数为7,大于4,易得电子;同一纵行的元素的最外层电子数相等,因此它们的化学性质相似;
故答案为:金属;Mg2+;得;相似;
⑤原子序数为8的是氧元素,原子序数为6的是碳元素,则反应物为一个碳原子和一个氧原子构成的CO分子、两个氧原子构成的O2分子;而生成物为2个由碳原子和氧原子构成的CO2分子;
故答案为:2CO+O2
| ||
点评:原子结构示意图用来表示原子的构成,根据原子结构示意图可对原子种类、性质及变化规律进行判断和推断.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目




