题目内容
(2009?普陀区二模)30℃时,NaOH溶解于水的实验数据如下表.| 实验序号 | 水的质量(克) | 加入NaOH质量(克) | 所得溶液质量(克) |
| ① | 10 | 5 | 15 |
| ② | 10 | 10 | 20 |
| ③ | 10 | 15 | 21 |
| ④ | 10 | 20 | 21 |
(2)实验②所得的溶液是溶液(填饱和或不饱和).
(3)30℃时,NaOH的溶解度为克/100克水
(4)如果在实验②中,滴加足量的硫酸铜溶液,则会生成mol沉淀,该反应的化学方程式.
【答案】分析:利用数据表中四次实验溶剂、所加入物质及溶液质量的变化,分析物质的溶解情况;根据对物质溶解情况的分析判断解答.
解答:解:
(1)实验①中,5gNaOH能全部溶于10g水形成15g溶液,故溶液的质量分数为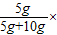 100%=33.3%;
100%=33.3%;
(2)对比②③的实验数据,加入15g该物质时所得溶液为21g,大于实验②的20g溶液,说明10g水溶解10g该物质时并未达到饱和状态;故②中所得溶液是不饱和溶液;
(3)根据实验③所得数据,30℃时10g水溶解21g-10g=11g该物质时溶液为饱和溶液,即30℃时10g水中含有11g该物质;故30℃时,NaOH的溶解度为110g;
(4)设产生的沉淀的质量为x,
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 98
10g x
 x=
x= g
g
 =0.125mol.
=0.125mol.
故答案为:(1)33.3%;(2)不饱和;(3)110;(4)0.125;2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.
点评:理解“饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液;溶液饱和的标志是溶液中有固体剩余,且剩余固体的量不再减少”是解此类题的关键.
解答:解:
(1)实验①中,5gNaOH能全部溶于10g水形成15g溶液,故溶液的质量分数为
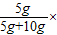 100%=33.3%;
100%=33.3%;(2)对比②③的实验数据,加入15g该物质时所得溶液为21g,大于实验②的20g溶液,说明10g水溶解10g该物质时并未达到饱和状态;故②中所得溶液是不饱和溶液;
(3)根据实验③所得数据,30℃时10g水溶解21g-10g=11g该物质时溶液为饱和溶液,即30℃时10g水中含有11g该物质;故30℃时,NaOH的溶解度为110g;
(4)设产生的沉淀的质量为x,
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 98
10g x
 x=
x= g
g  =0.125mol.
=0.125mol.故答案为:(1)33.3%;(2)不饱和;(3)110;(4)0.125;2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.
点评:理解“饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液;溶液饱和的标志是溶液中有固体剩余,且剩余固体的量不再减少”是解此类题的关键.

练习册系列答案
相关题目
(2009?普陀区二模)人类的生产活动离不开金属,下列三种金属被发现使用的先后顺序依次为:铜、铁、铝.
(1)金属大规模被使用的先后顺序跟______有关
①金属的导电性 ②地壳中金属元素的含量 ③金属的活动性
(2)为探究金属Mg、Fe、Mn的活动性,在相同温度下,取大小相同、表面光亮的三种金属薄片分别投入等体积、等浓度的足量稀盐酸中(反应中Mn显+2价),请回答:
(3)写出上述任一条反应方程式:______
(4)除了用上述方法外,请你再设计一种方法证明三者的活动性:(药品自选,纯净的Mn是一种银灰色的金属)
(1)金属大规模被使用的先后顺序跟______有关
①金属的导电性 ②地壳中金属元素的含量 ③金属的活动性
(2)为探究金属Mg、Fe、Mn的活动性,在相同温度下,取大小相同、表面光亮的三种金属薄片分别投入等体积、等浓度的足量稀盐酸中(反应中Mn显+2价),请回答:
| 金属 | Mg | Fe | Mn |
| 反应现象 | 放出气泡速率很快 | 放出气泡速率很慢 | 放出气泡速率较快 |
| 结论 | 三种金属的活动性:______>______>______ | ||
(4)除了用上述方法外,请你再设计一种方法证明三者的活动性:(药品自选,纯净的Mn是一种银灰色的金属)
| 验证方法 | 现象与结论 |

 (2009?普陀区二模)为了鉴别Na2CO3、NaCl、KCl这三种固体样品,某同学分别取样配制成溶液并设计了如图所示的实验方案.
(2009?普陀区二模)为了鉴别Na2CO3、NaCl、KCl这三种固体样品,某同学分别取样配制成溶液并设计了如图所示的实验方案.