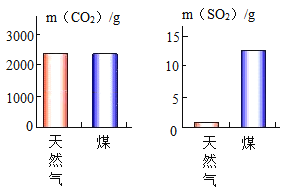
题目内容
【题目】氢气作为新能源有很多优点,制取不储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:
6Zn+Fe2O4![]() 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O![]() 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑
(1)ZnFe2O4 中 Fe 的化合价为____。
(2)该循环制氢中不断消耗的物质是____(填化学式),得到H2和O2 的质量比为____。
(3)氢气作为新能源的优点有____(任写一点)。该循环法制氢的不足之处是____。
Ⅱ.贮氢:合金 Mg2Cu 是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu 单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学 方程式为: 2Mg2Cu+ 3H2![]() 3MgH2+MgCu2
3MgH2+MgCu2
(4)熔炼制备 Mg2Cu 合金时,通入氩气的目的是____。
(5)氢化物 MgH2 不水反应生成一种碱,并释放出 H2。 其化学反应方程式为____。
【答案】+3 H2O 1:8 热值高 /无污染 能耗高 起到保护作用,防止金属被 氧化 MgH2 + 2H2O = Mg(OH)2 + 2H2↑
【解析】
(1)ZnFe2O4中锌的化合价为+2价,氧元素的化合价为-2,设Fe的化合价为x,则有(+2)+2x+(-2)×4=0,x=+3;
(2)该循环制氢中不断消耗的物质是水,其化学式为H2O,得到H2和O2的质量比为4:32=1:8;
(3)氢气作为新能源的优点有不污染环境、热值大、原料来源丰富,该循环法制氢的不足之处是耗能太大;
(4)熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化;
(5)氢化物MgH2与水反应生成氢氧化镁,并释放出H2.其化学反应方程式为 MgH2+2H2O=Mg(OH)2↓+2H2↑。

【题目】(科普阅读)
| ① 木糖醇是从植物中提取出来的一种天然甜味剂,广泛存在于各种水果、蔬菜、谷类之中 |
| ② 木糖醇为白色晶体或结晶性粉末,极易溶于水,溶解时会吸收一定热量。 |
| ③ 木糖醇在一定程度上有助于牙齿的清洁度,但是过度的食用,也有可能带来腹泻等副作用,这一点也不可忽视。 |
C5H12O5 | ④ 木糖醇是一种五碳糖醇,木糖醇的甜度与砂糖相同,但热量却只有砂糖的75%。木糖醇是人体糖类代谢的正常中间体,它的代谢不同于一般糖类,主要与氧气反应生成二氧化碳和水,放出热量,被人利用。 |
依据文章内容,回答下列问题:
(1)木糖醇的物理性质是___________________。
(2)木糖醇入口有清凉感觉的原因是________________。
(3)木糖醇在人体内发生的反应可以用文字表达式表示为(反应条件略去)__________。