题目内容
【题目】采用适当的试剂,从石灰石(主要成分为CaCO3)获得高纯度CaCO3的流程如下
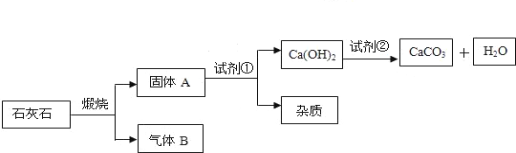
① 写出石灰石煅烧的化学方程式 ;写出固体A 与试剂①反应的化学方程式 ;
②上述流程中有的物质可以再利用,请在流程图上用箭头标示再利用的路线(箭头要求:从可利用的物质出发,指向利用该物质的环节);
③为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放入烧杯中,加入稀盐酸进行反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示:
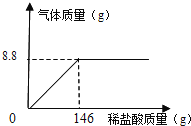
计算:样品中碳酸钙的质量百分含量是多少?(写出计算过程)
【答案】 煅烧石灰石的化学方程式为:CaCO3![]() CaO + CO2↑;CaO+H2O===Ca(OH)2;2个循环箭头(略);80%
CaO + CO2↑;CaO+H2O===Ca(OH)2;2个循环箭头(略);80%
【解析】
试题分析:煅烧石灰石的化学方程式为:CaCO3![]() CaO + CO2↑,固体A为生石灰,生石灰与水反应,生成氢氧化钙,方程式为:CaO+H2O===Ca(OH)2;(由固体A和试剂1反应生成氢氧化钙,可知试剂1是水,在CO2 + Ca(OH)2 = CaCO3↓+ H2O反应中水又是生成物,所以水可以循环使用;氢氧化钙与试剂2反应,生成碳酸钙,可知试剂2为二氧化碳,而在煅烧石灰石时又能得到二氧化碳,所以二氧化碳也可以循环使用。先根据二氧化碳的质量,计算出样品中碳酸钙的质量,最后用碳酸钙的质量除以样品的质量。
CaO + CO2↑,固体A为生石灰,生石灰与水反应,生成氢氧化钙,方程式为:CaO+H2O===Ca(OH)2;(由固体A和试剂1反应生成氢氧化钙,可知试剂1是水,在CO2 + Ca(OH)2 = CaCO3↓+ H2O反应中水又是生成物,所以水可以循环使用;氢氧化钙与试剂2反应,生成碳酸钙,可知试剂2为二氧化碳,而在煅烧石灰石时又能得到二氧化碳,所以二氧化碳也可以循环使用。先根据二氧化碳的质量,计算出样品中碳酸钙的质量,最后用碳酸钙的质量除以样品的质量。
解:设样品中碳酸钙的质量为X
根据题意知,生成二氧化碳的质量为8.8克
CaCO3+2HCl→CaCl2+CO2↑+H2O
100 44
X 8.8g
100/44=X/8.8g
X=20g
碳酸钙的质量=20g/25g*100%=80%
答:样品中碳酸钙的质量分数为80%

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目





