题目内容
某研究性学习小组对双氧水开展如下研究.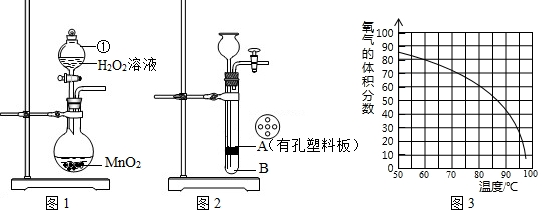
(1)图1装置中仪器①的名称为______.
(2)小林同学将MnO2与水泥按一定比例混合,制作成小块状固体,加入图2装置中制氧气以方便实验结束回收二氧化锰.其中块状固体应放置在______处(填“A”或“B”),二氧化锰的作用是______,该装置中反应的文字表达式是______.利用该装置反应一段时间后,需停止反应,其操作是______,原因是______.
(3)小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究.
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其总容积10%、20%、30%、40%、50%的水.用排水法收集氧气,恰好把5只集气瓶中的水排去.将带火星的术条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二组和第三组实验.三组实验的数据和现象见下表.
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
①本实验中使用带火星的木条验满氧气的方法是否可靠:______(填“是”或“否”).
②收集的氧气占容积的体积分数最低为______%时,可使带火星的木条复燃,这时集气瓶中氧气的体积分数是______%(计算结果保留整数).
③用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸气所致,此时混合气体中氧气的体积分数随温度变化的曲线如图3所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在______℃.
解:(1)由图可知,仪器①为分液漏斗,故答案为:分液漏斗;
(2)因装置为固体与液体反应装置,则块状固体可放在有孔塑料板上,则放在A处,二氧化锰在反应前后的质量不变,在该反应中作催化剂,即双氧水在二氧化锰的催化作用下分解生成水和氧气,若要停止反应,则可关闭活塞,产生的气体使试管中压强增大,液体被压回长颈漏斗中,固液分离,反应停止,
故答案为:A;催化作用; 过氧化氢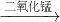 水+氧气;关闭活塞;关闭活塞后,产生的气体使试管中压强增大,液体被压回长颈漏斗中,固液分离,反应停止;
水+氧气;关闭活塞;关闭活塞后,产生的气体使试管中压强增大,液体被压回长颈漏斗中,固液分离,反应停止;
(3)①通过实验可以看出,氧气含量达到35%带火星的木条就可以复燃,所以用带火星的木条验满氧气的方法不可靠,故答案为:否;
②由图中可知,当氧气的体积分数达到35%时,带火星的木条复燃,即收集的氧气占容积的体积分数最低为35%,此时空气还占65%,所以空气中有氧气的量为:65%×21%≈14%,所以此时瓶内共有氧气的分数为14%+35%=49%,故答案为:35;49;
③只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,则氧气的含量需要在图3坐标中的49%处,向横坐标作垂线,则可知温度大约在87℃左右,故答案为:87;
分析:(1)根据化学实验常见仪器的名称及图中所指的仪器来解答;
(2)根据固体的形状来分析位置,利用二氧化锰在反应前后的质量不变分析其作用,根据反应物与生成物来书写文字表达式,利用压强来分析可停止反应的原因;
(3)根据几组氧气含量不同的对照实验可以看出,不是纯净的氧气也能使带火星的木条复燃;分析表格可发现收集的氧气占容积的体积分数最低为35%时木条也可复燃,根据空气中原有的氧气和收集到的氧气,就可算出氧气的分数;利用图3来确定需要的温度来分析解答.
点评:本题考查了双氧水的分解实验及探究能使带火星的木条复燃需要的氧气的浓度,习题较难,学生应注意设计实验时,要明确实验的目的,特别要注意控制实验中的一些变量来分析,注重实验数据及图象的分析处理及应用来解答.
(2)因装置为固体与液体反应装置,则块状固体可放在有孔塑料板上,则放在A处,二氧化锰在反应前后的质量不变,在该反应中作催化剂,即双氧水在二氧化锰的催化作用下分解生成水和氧气,若要停止反应,则可关闭活塞,产生的气体使试管中压强增大,液体被压回长颈漏斗中,固液分离,反应停止,
故答案为:A;催化作用; 过氧化氢
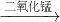 水+氧气;关闭活塞;关闭活塞后,产生的气体使试管中压强增大,液体被压回长颈漏斗中,固液分离,反应停止;
水+氧气;关闭活塞;关闭活塞后,产生的气体使试管中压强增大,液体被压回长颈漏斗中,固液分离,反应停止;(3)①通过实验可以看出,氧气含量达到35%带火星的木条就可以复燃,所以用带火星的木条验满氧气的方法不可靠,故答案为:否;
②由图中可知,当氧气的体积分数达到35%时,带火星的木条复燃,即收集的氧气占容积的体积分数最低为35%,此时空气还占65%,所以空气中有氧气的量为:65%×21%≈14%,所以此时瓶内共有氧气的分数为14%+35%=49%,故答案为:35;49;
③只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,则氧气的含量需要在图3坐标中的49%处,向横坐标作垂线,则可知温度大约在87℃左右,故答案为:87;
分析:(1)根据化学实验常见仪器的名称及图中所指的仪器来解答;
(2)根据固体的形状来分析位置,利用二氧化锰在反应前后的质量不变分析其作用,根据反应物与生成物来书写文字表达式,利用压强来分析可停止反应的原因;
(3)根据几组氧气含量不同的对照实验可以看出,不是纯净的氧气也能使带火星的木条复燃;分析表格可发现收集的氧气占容积的体积分数最低为35%时木条也可复燃,根据空气中原有的氧气和收集到的氧气,就可算出氧气的分数;利用图3来确定需要的温度来分析解答.
点评:本题考查了双氧水的分解实验及探究能使带火星的木条复燃需要的氧气的浓度,习题较难,学生应注意设计实验时,要明确实验的目的,特别要注意控制实验中的一些变量来分析,注重实验数据及图象的分析处理及应用来解答.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目