题目内容
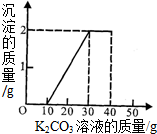
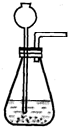
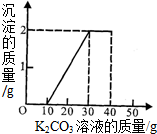
某班同学利用了右图的发生装置完成了实验室制取二氧化碳的实验,实验后对回收的溶液进行了以下实验:取40mL该溶液于烧杯中,滴入40g溶质质量分数为13.8%的K2CO3溶液.滴入K2CO3溶液质量与生成沉淀
质量的关系如下图所示.请完成下列各题:
(1)实验室制取二氧化碳的化学方程式为
(2)请分析所取40mL溶液呈
(3)参加反应的K2CO3溶液中所含的溶质的质量为
为
(4)如果实验室里只有碳酸钠粉末和稀盐酸,请你设计一个反应平稳安全且能持续产生二氧化碳气体的实验,需要对上述发
生装置进行改动的是
分析:(1)实验室利用大理石或石灰石与稀盐酸反应来制取二氧化碳气体;根据反应物和生成物即可写出化学反应方程式;
(2)根据加入碳酸钾而得不到沉淀,说明溶液中有能够消耗碳酸根的微粒,从而导致碳酸根无法与钙离子形成沉淀.所以溶液是酸性的.其他微粒可以根据质量守恒定律来推断.
(3)碳酸钾溶液的质量分数可以根据沉淀产生对应的消耗的碳酸钾溶液的质量30-10=20g溶液进行计算.而反应后所得固体是KCl,无论是和盐酸反应的,还是和氯化钙反应的,都是KCl,所以可以根据碳酸钾关系式法求算.
(4)平稳气流主要是试剂的平稳持续的接触,所以可以用能够控制滴加速度的分液漏斗来实现.
(2)根据加入碳酸钾而得不到沉淀,说明溶液中有能够消耗碳酸根的微粒,从而导致碳酸根无法与钙离子形成沉淀.所以溶液是酸性的.其他微粒可以根据质量守恒定律来推断.
(3)碳酸钾溶液的质量分数可以根据沉淀产生对应的消耗的碳酸钾溶液的质量30-10=20g溶液进行计算.而反应后所得固体是KCl,无论是和盐酸反应的,还是和氯化钙反应的,都是KCl,所以可以根据碳酸钾关系式法求算.
(4)平稳气流主要是试剂的平稳持续的接触,所以可以用能够控制滴加速度的分液漏斗来实现.
解答:解:(1)实验室制取二氧化碳的原理是盐酸与碳酸钙制取,所以对应的方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑故填:CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)由于开始加入的碳酸钾没有生成对应的沉淀,说明溶液中有物质能够消耗碳酸根而无法使碳酸根与钙离子结合.所以溶液为酸性的.由于是碳酸钙和盐酸反应后的液体,所以溶液中一定有 Ca2+、H+、Cl-、H2O.水分子很容易被忽略掉.这个在解题时要多加注意.故填:酸; Ca2+、H+、Cl-、H2O.
(3)当沉淀产生2g时,与沉淀有关的溶液消耗是30g-10g=20g.所以设碳酸钾溶液的质量分数为x
K2CO3+CaCl2═2KCl+CaCO3↓
138 100
20g×x 2g
=
x═13.8%
恰好反应时消耗的碳酸钾溶液的总质量为30g,所以共有碳酸钾的质量为13.8%×30g=4.14g.
设反应后所得固体氯化钾的质量为y.
由于反应后所得溶液中的KCl和碳酸钾中钾元素相等,所以根据关系式法可得
K2CO3~~~~2KCl
138 149
4.14g y
=
y=4.47g.
(4)为获得平稳气流,需要加入试剂的速度保持平稳,所以可以采用分液漏斗来适当控制反应的速度.故填:分液漏斗.
(2)由于开始加入的碳酸钾没有生成对应的沉淀,说明溶液中有物质能够消耗碳酸根而无法使碳酸根与钙离子结合.所以溶液为酸性的.由于是碳酸钙和盐酸反应后的液体,所以溶液中一定有 Ca2+、H+、Cl-、H2O.水分子很容易被忽略掉.这个在解题时要多加注意.故填:酸; Ca2+、H+、Cl-、H2O.
(3)当沉淀产生2g时,与沉淀有关的溶液消耗是30g-10g=20g.所以设碳酸钾溶液的质量分数为x
K2CO3+CaCl2═2KCl+CaCO3↓
138 100
20g×x 2g
| 138 |
| 100 |
| 20g×x |
| 2g |
x═13.8%
恰好反应时消耗的碳酸钾溶液的总质量为30g,所以共有碳酸钾的质量为13.8%×30g=4.14g.
设反应后所得固体氯化钾的质量为y.
由于反应后所得溶液中的KCl和碳酸钾中钾元素相等,所以根据关系式法可得
K2CO3~~~~2KCl
138 149
4.14g y
| 138 |
| 149 |
| 4.14g |
| y |
y=4.47g.
(4)为获得平稳气流,需要加入试剂的速度保持平稳,所以可以采用分液漏斗来适当控制反应的速度.故填:分液漏斗.
点评:计算反应后所得氯化钾,由于盐酸和碳酸钾反应能够得到氯化钾,氯化钙与之也能得到,所以求算时计算量偏大,此时可以考虑根据元素守恒来计算,而不需要考虑具体形成的路径,这样可以减少计算量,也提高了计算效率.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目