题目内容
创新并不高深莫测,对实验进行改进是创新的表现方式之一.一个实验步骤的变化,一个实验装置的改进会收到意想不到的效果.今天,同学们再来体验一把.
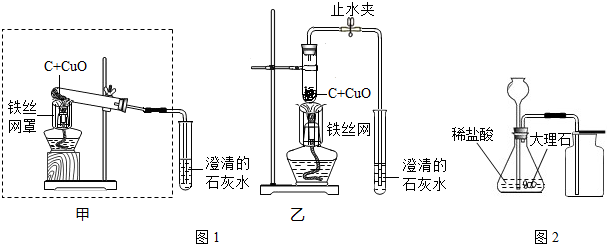
【实验一】碳还原氧化铜(图1)
(1)方框内装置还能制取的气体是
(2)若用3gC和15gCuO进行实验,反应的化学方程式为
(3)稳定的高温是C还原CuO成功的关键之一.用装置乙代替甲可以让固体混合物受热均匀,获得稳定、均匀的高温,提高该实验的成功率.由于试管中有空气等原因,操作时须将试管口略向下倾斜进行预热,其目的是
①使试管受热均匀
②减少试管内空气的量,防止氧气对实验的影响
③赶跑夹在反应物中的水汽,防水汽凝结倒流
④提高反应物的温度
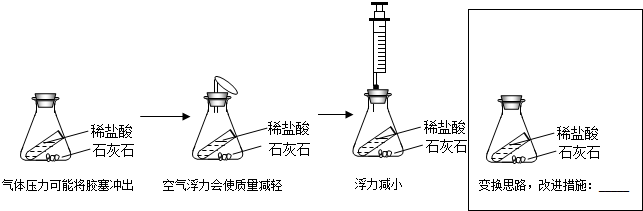
【实验二】验证质量守恒定律(图2)
(1)产生CO2的化学方程式为
(2)验证质量守恒定律时还需的测量仪器是
①不便称量 ②气体易逸散 ③收集不到气体
小希认为应把实验设计在一个密闭的容器中完成.下面是他完善装置的思维过程,请你将方框内装置(画出添加的仪器、标出药品名称),短线上内容补充完整.
【归纳总结】用有气体生成的反应验证质量守恒定律应在密闭的容器中进行,且要注意分压.
【实验一】碳还原氧化铜(图1)
(1)方框内装置还能制取的气体是
O2
O2
(填化学式).(2)若用3gC和15gCuO进行实验,反应的化学方程式为
C+CuO
2Cu+CO↑
| ||
C+CuO
2Cu+CO↑
,乙装置明显的缺陷是
| ||
缺少尾气处理装置
缺少尾气处理装置
.(3)稳定的高温是C还原CuO成功的关键之一.用装置乙代替甲可以让固体混合物受热均匀,获得稳定、均匀的高温,提高该实验的成功率.由于试管中有空气等原因,操作时须将试管口略向下倾斜进行预热,其目的是
①②③
①②③
.(填序号).①使试管受热均匀
②减少试管内空气的量,防止氧气对实验的影响
③赶跑夹在反应物中的水汽,防水汽凝结倒流
④提高反应物的温度
【实验二】验证质量守恒定律(图2)

(1)产生CO2的化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(2)验证质量守恒定律时还需的测量仪器是
托盘天平
托盘天平
,装置的不足之处 有①②
①②
(填序号).①不便称量 ②气体易逸散 ③收集不到气体
小希认为应把实验设计在一个密闭的容器中完成.下面是他完善装置的思维过程,请你将方框内装置(画出添加的仪器、标出药品名称),短线上内容补充完整.

【归纳总结】用有气体生成的反应验证质量守恒定律应在密闭的容器中进行,且要注意分压.
分析:【实验一】(1)根据装置的特点分析能制取的气体;
(2)根据在高温条件下碳与氧化铜的质量比分析反应产物.写出反应的方程式,根据反应有生成的一氧化碳会污染空气分析装置的缺陷;
(3)对比将试管口略向下倾斜进行预热与试管竖直加热的优缺点分析回答;
【[实验二】(1)根据碳酸钙与盐酸的反应写出反应的方程式;
(2)要测定质量守恒还需的测量仪器是托盘天平;根据碳酸钙与盐酸反应生成了气体分析装置的不足之处;根据氢氧化钠能上吸收二氧化碳分析补充的内容.
(2)根据在高温条件下碳与氧化铜的质量比分析反应产物.写出反应的方程式,根据反应有生成的一氧化碳会污染空气分析装置的缺陷;
(3)对比将试管口略向下倾斜进行预热与试管竖直加热的优缺点分析回答;
【[实验二】(1)根据碳酸钙与盐酸的反应写出反应的方程式;
(2)要测定质量守恒还需的测量仪器是托盘天平;根据碳酸钙与盐酸反应生成了气体分析装置的不足之处;根据氢氧化钠能上吸收二氧化碳分析补充的内容.
解答:解:【实验一】(1)由装置的特点可知,该装置是加热固体可用来制取O2;
(2)在高温条件下,由碳与氧化铜的质量是比是3:15,当碳与氧化铜的反应生成了铜和一氧化碳的质量比是3:20,所以碳有剩余,所以,该反应的方程式是:C+CuO
2Cu+CO↑,由于反应有生成的一氧化碳会污染空气.所以装置的缺陷是缺少尾气处理装置;
(3)操作时须将试管口略向下倾斜进行预热,其目的是使试管受热均匀,由于还原出的铜能与氧气反应,还可以减少试管内空气的量,防止氧气对实验的影响,还可以赶跑夹在反应物中的水汽,防水汽凝结倒流,引起试管的炸裂.
【实验二】(1)由装置内的药品可知,碳酸钙与盐酸反应生成了二氧化碳,产生CO2的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)验证质量守恒定律时还需的测量仪器是托盘天平.由碳酸钙与盐酸反应生成了二氧化碳气体,所以,装置的不足之处气体不便称量、气体易逸散的缺点.由于氢氧化钠能吸收二氧化碳,所以小希完善装置的变换思路、改进的措施是:用吸收剂吸收二氧化碳,装置如下:
故答为:【实验一】(1)O2;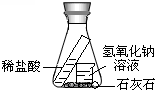
(2)C+CuO
2Cu+CO↑,缺少尾气处理装置;
(3)①②③.
【实验二】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)托盘天平,①②;
(3)用吸收剂吸收二氧化碳.装置见图.
(2)在高温条件下,由碳与氧化铜的质量是比是3:15,当碳与氧化铜的反应生成了铜和一氧化碳的质量比是3:20,所以碳有剩余,所以,该反应的方程式是:C+CuO
| ||
(3)操作时须将试管口略向下倾斜进行预热,其目的是使试管受热均匀,由于还原出的铜能与氧气反应,还可以减少试管内空气的量,防止氧气对实验的影响,还可以赶跑夹在反应物中的水汽,防水汽凝结倒流,引起试管的炸裂.
【实验二】(1)由装置内的药品可知,碳酸钙与盐酸反应生成了二氧化碳,产生CO2的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)验证质量守恒定律时还需的测量仪器是托盘天平.由碳酸钙与盐酸反应生成了二氧化碳气体,所以,装置的不足之处气体不便称量、气体易逸散的缺点.由于氢氧化钠能吸收二氧化碳,所以小希完善装置的变换思路、改进的措施是:用吸收剂吸收二氧化碳,装置如下:
故答为:【实验一】(1)O2;

(2)C+CuO
| ||
(3)①②③.
【实验二】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)托盘天平,①②;
(3)用吸收剂吸收二氧化碳.装置见图.
点评:本题的难度较大,主要考查了对实验装置和实验步骤的改进.只有平时的实验中,加强实验,提高实验的能力,在熟练掌握了常见的装置和实验步骤的基础上,才能完成本题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目