题目内容
【题目】化学奋进小组同学们对氢氧化钠进行了相关实验探究。
探究一:探究氧化钠的物理性质
用镊子夹取3小块氢氧化钠分别进行如下实验:
实验 | 现象 |
(1)观察氢氧化钠的颜色和状态 | __________________________ |
(2)将氢氧化钠放在表面皿上,放置一 会儿 | ___________________________ |
(3)将氢氧化钠放入盛有少量水的试管 里溶解,并用手轻触碰试管外壁 | ____________________________ |
探究二:探究氢氧化钠的化学性质

(1)实验Ⅰ中观察到的现象是____________________。实验Ⅳ中观察到的现象是________________, 化学方程式为_______________________________________。
(2)实验Ⅱ和实验Ⅲ中没有明显现象,为验证实验Ⅱ和实验Ⅲ中是否发生了化学反应,请你设计相关实验方案:
实验步骤 | 实验现象 | 实验结论 | |
验证实验Ⅱ | 取实验中通入二氧化碳后的溶液,向溶液中滴加_______。 | 有气泡产生 | 实验Ⅱ中发生了 化学反应 |
验证实验Ⅲ | _______________ | _____________ | 实验Ⅲ中发生了 化学反应 |
实验Ⅱ中发生化学反应的化学方程式是______________________
(3)通过上述实验探究,奋进小组总结出能和氢氧化钠反应的物质类别是____、盐。(填字母序号)
a.单质 b.氧化物 c.酸 d.碱
【答案】白色固体 固体潮湿逐渐溶解 试管外壁发热 溶液由无色变成红色 产生蓝色沉淀 ![]() 稀盐酸 实验Ⅲ中滴加稀盐酸后,再向溶液中滴加硫酸铜溶液 没有产生蓝色沉淀 Na2CO3+2HCl═2NaCl+H2O+CO2↑ bc
稀盐酸 实验Ⅲ中滴加稀盐酸后,再向溶液中滴加硫酸铜溶液 没有产生蓝色沉淀 Na2CO3+2HCl═2NaCl+H2O+CO2↑ bc
【解析】
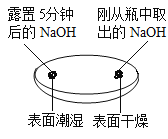
探究一:氢氧化钠是一种白色固体,易溶于水,溶解时放出热量;暴露在空气中的氢氧化钠固体易吸收空气中的水蒸气而逐渐溶解;
探究二:(1)氢氧化钠溶液显碱性,能使无色的酚酞试液变红色;氢氧化钠能与硫酸铜发生复分解反应生成硫酸钠和氢氧化铜蓝色沉淀,化学方程式为:![]() ;
;
(2)实验Ⅱ中通入二氧化碳看不到明显现象,再滴加稀盐酸后,会观察到有气泡冒出,这是因为碳酸钠和盐酸反应生成了二氧化碳,证明实验Ⅱ中发生了化学反应;
向盛有氢氧化钠溶液的试管中滴加稀盐酸后,再滴加硫酸铜溶液,若没有产生蓝色沉淀,说明实验Ⅲ中发生了化学反应;
实验Ⅱ中发生化学反应是二氧化碳与氢氧化钠反应生成碳酸钠和水,滴加盐酸,碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,反应的化学方程式是:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)通过上述实验探究,奋进小组总结出能和氢氧化钠反应的物质有氧化物、酸、盐,故填bc。

【题目】同学们运用对比的学习方法探究碱的性质。
实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
|
|
|
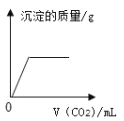
(1)由实验一、二可知,氢氧化钠会吸收空气中的______________,因此要密封保存。
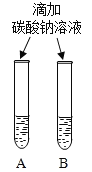
(2)实验三中观察到3个塑料瓶变瘪的程度为A>B>C,对比A瓶与_____ (填“ B”或“C” )瓶的实验现象,可证明CO2能与NaOH发生反应。
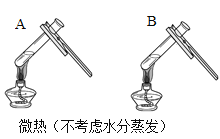
(3)同学们设计如下两种方案鉴别氢氧化钠和氢氧化钙两种饱和溶液。
方案一 | 方案二 | 分析 |
|
| 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为_____________;方案二的设计原理是___________________。 |
(4)某同学发现工业上使用的氢氧化钠固体标签如右图所示,于是对其成分进行了探究:

[提出问题]氢氧化钠中含有什么杂质?
[查阅资料]①在化工生产中,原料往往不能完全转化为产品。
②工业上制取NaOH的反应原理是:  ,然后蒸发溶剂获得NaOH固体。
,然后蒸发溶剂获得NaOH固体。
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
[提出猜想]氢氧化钠中含有的杂质为碳酸钠和氯化钠。
提出上述猜想的理由是_____________________________。
[进行实验]取固体于试管中,加水溶解并向溶液中加入过量稀盐酸。
[实验结论]溶液中有明显现象,证明杂质中一定含有碳酸钠。
[反思评价]该同学想进一步证明固体中含有氢氧化钠,实验方案是________________________。
(5)某碳酸钠样品中含有少量氯化钠。现称量11 g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1 g氯化钠固体。计算:
①碳酸钠样品中碳酸钠的质量_________;
②反应后所得溶液中溶质的质量分数_________。(结果精确到0. 1% )