��Ŀ����
29�����ý������������˳����й�֪ʶ����������⣮
��1��ij��ȤС���ͬѧѧϰ�˽��������ʺ���ʵ�����ҵ���һ������ɫ����R������̽����
�ٽ�����RͶ��ϡ�����У���������������ð������ý���R�ڽ������˳������������
�ڽ�����RͶ�뵽FeSO4��Һ�У�����R�����к�ɫ��������������������Ϣ���жϽ���Fe��R��Cu�����ǿ������˳����
��2����ҵ�����г���10%��ϡ������������Ʒ��������⣬д����������ⷴӦ�Ļ�ѧ����ʽ
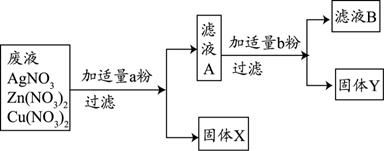
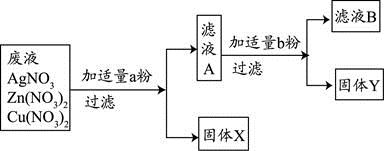
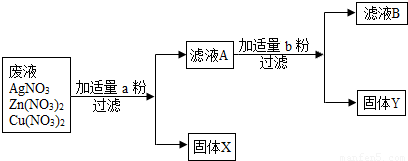
��3��ijУʵ���ҷ�ˮ�к���Zn��NO3��2��AgNO3��Cu��NO3��2�������ʣ���У��ѧ��ȤС���ͬѧΪ�˴��з��롢���ս���Ag��Cu�����������ʵ�鷽����ʵ����δ���������������ӣ���
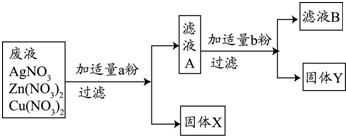
�ش����⣺
�ٹ���X��
��д��ʵ���������������Ӧ�Ļ�ѧ����ʽ
��1��ij��ȤС���ͬѧѧϰ�˽��������ʺ���ʵ�����ҵ���һ������ɫ����R������̽����
�ٽ�����RͶ��ϡ�����У���������������ð������ý���R�ڽ������˳������������
ǰ��
��ѡ�ǰ�桱���桱�����ڽ�����RͶ�뵽FeSO4��Һ�У�����R�����к�ɫ��������������������Ϣ���жϽ���Fe��R��Cu�����ǿ������˳����
R��Fe��Cu
����2����ҵ�����г���10%��ϡ������������Ʒ��������⣬д����������ⷴӦ�Ļ�ѧ����ʽ
Fe2O3+6HCl=2FeCl3+3H2O
����Ҫ���Ƹ�����600g������Ҫ������������Ϊ40%��Ũ���ᣨ�ܶ�Ϊ1.2g/mL��
125
mL����3��ijУʵ���ҷ�ˮ�к���Zn��NO3��2��AgNO3��Cu��NO3��2�������ʣ���У��ѧ��ȤС���ͬѧΪ�˴��з��롢���ս���Ag��Cu�����������ʵ�鷽����ʵ����δ���������������ӣ���

�ش����⣺
�ٹ���X��
Ag
����д��ʵ���������������Ӧ�Ļ�ѧ����ʽ
Cu+2AgNO3=2Ag+Cu��NO3��2 Zn+Cu��NO3��2=Cu+Zn��NO3��2
�����������ݽ������˳��Ĺ����������ǰ��Ľ������Ժ��ᷴӦ�����κ�����������ǰ��Ľ�������������������Һ��Ӧ�����κ���һ�ֽ�����д��������ⷴӦ�Ļ�ѧ����ʽʱҪȷд��������Ȼ����Ļ�ѧʽ����ƽ������Ũ��������������Һϡ��ǰ�����ʵ��������䣬��Zn��NO3��2��AgNO3��Cu��NO3��2���������з�����ս���Ag��Cuʱ�����ݽ������Ҫ�ȷ���������ٷ���ͭ��
����⣺��1���ٽ�����RͶ��ϡ�����У���������������ð����˵������R������ã��ڽ������˳������������ǰ��
�ڽ�����RͶ�뵽FeSO4��Һ�У�����R�����к�ɫ���������� ˵��R�������ã�����Fe��R��Cu�����ǿ������˳���� R��Fe��Cu��
��2����������ⷴӦ�Ļ�ѧ����ʽ��Fe2O3+6HCl=2FeCl3+3H2O����Ҫ���Ƹ�����600g10%��ϡ���ᣬ����Ҫ������������Ϊ40%��Ũ���ᣨ�ܶ�Ϊ1.2g/mL��XmL������ϡ��ǰ����������������ʽ��600g��10%=XmL��1.2g/mL��40%
��� X=125
��3������ԭ��ˮ�м���������ͭ�ۣ�����ȫ���û����������˺�������Һ�м���������п�ۣ���ͭȫ���û�����������X�� Ag��
��д��ʵ���������������Ӧ�Ļ�ѧ����ʽ Cu+2AgNO3=2Ag+Cu��NO3��2Zn+Cu��NO3��2=Cu+Zn��NO3��2
�𰸣���1����ǰ���R��Fe��Cu��
��2�� Fe2O3+6HCl=2FeCl3+3H2O�� 125mL
��3����Ag��
��Cu+2AgNO3=2Ag+Cu��NO3��2
Zn+Cu��NO3��2=Cu+Zn��NO3��2
�ڽ�����RͶ�뵽FeSO4��Һ�У�����R�����к�ɫ���������� ˵��R�������ã�����Fe��R��Cu�����ǿ������˳���� R��Fe��Cu��
��2����������ⷴӦ�Ļ�ѧ����ʽ��Fe2O3+6HCl=2FeCl3+3H2O����Ҫ���Ƹ�����600g10%��ϡ���ᣬ����Ҫ������������Ϊ40%��Ũ���ᣨ�ܶ�Ϊ1.2g/mL��XmL������ϡ��ǰ����������������ʽ��600g��10%=XmL��1.2g/mL��40%
��� X=125
��3������ԭ��ˮ�м���������ͭ�ۣ�����ȫ���û����������˺�������Һ�м���������п�ۣ���ͭȫ���û�����������X�� Ag��
��д��ʵ���������������Ӧ�Ļ�ѧ����ʽ Cu+2AgNO3=2Ag+Cu��NO3��2Zn+Cu��NO3��2=Cu+Zn��NO3��2
�𰸣���1����ǰ���R��Fe��Cu��
��2�� Fe2O3+6HCl=2FeCl3+3H2O�� 125mL
��3����Ag��
��Cu+2AgNO3=2Ag+Cu��NO3��2
Zn+Cu��NO3��2=Cu+Zn��NO3��2
�����������ۺ��˽������˳���Ӧ�ã���ѧ����ʽ����ѧ���㣬��ͼ�ƶϵȶ��֪ʶ��Ŀ��飮

��ϰ��ϵ�д�
�����Ŀ