题目内容
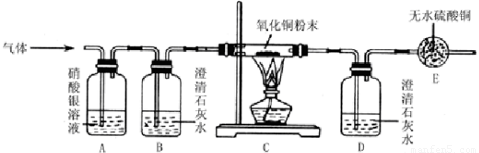
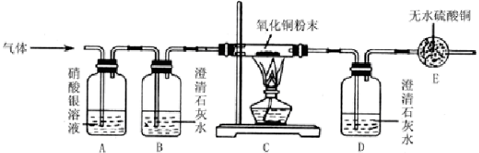 某气体样品中可能含有H2O、CO、CO2、HCl中的一种或几种,某同学在探究该气体成分的活动中,采用了如图所示的装置.实验过程中发现白色硫酸铜粉末慢慢变蓝,黑色氧化铜变红.而B澄清石灰水没有明显的变化,D中澄清石灰水变浑浊,A中无明显现象.下列说法错误的( )
某气体样品中可能含有H2O、CO、CO2、HCl中的一种或几种,某同学在探究该气体成分的活动中,采用了如图所示的装置.实验过程中发现白色硫酸铜粉末慢慢变蓝,黑色氧化铜变红.而B澄清石灰水没有明显的变化,D中澄清石灰水变浑浊,A中无明显现象.下列说法错误的( )分析:首先分析各装置的作用:A用来检验是否含有氯化氢气体,B检验是否有二氧化碳气体,后面的澄清石灰水是验证有没有二氧化碳生成,C是检验还原性气体,如氢气和一氧化碳,E装置检验是否有水;然后根据所看到的现象分析原因,推出结论.
解答:解:混合气通过后A中无明显现象,说明一定不含氯化氢气体,B澄清石灰水没有明显的变化,说明混合气中不含二氧化碳,则AB错误;黑色氧化铜没有变红,D中澄清石灰水变浑浊,说明一定含有一氧化碳,E处无水硫酸铜变蓝色,说明有水,但水不一定来自混合气,故CD正确;
故选A.
故选A.
点评:本题考查了以下知识:检验氯化氢气体是否存在用硝酸银溶液,检验二氧化碳用澄清石灰水,检验一氧化碳时先通过灼热的氧化铜,再通过澄清石灰水,检验水蒸气通过无水硫酸铜,据此结合装置图分析即可得正确答案.

练习册系列答案
相关题目