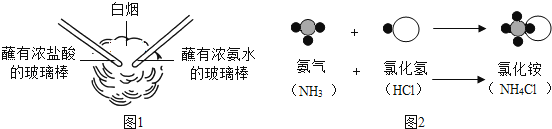
��Ŀ����
����Ŀ�����и�ͼͼ��ͬѧ������Ϥ��ʵ��װ�ã��������ĿҪ��ش��й����⣺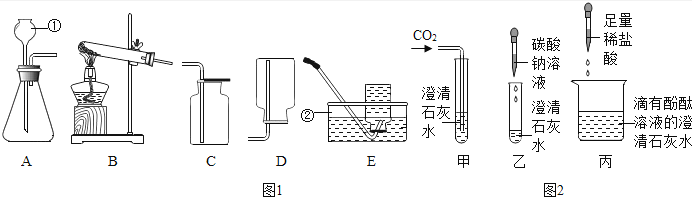
��1��д�����������ƣ������� ��
��2��ʵ��������Bװ���Ʊ��������÷�Ӧ�Ļ�ѧ����ʽΪ���� �����ռ�����ͨ��ѡ�õ�װ���� ������ĸ���ţ���
��3����ʵ��������ѡ��A��Cװ����ȡ������̼���壬�䷴Ӧԭ�����û�ѧ����ʽ��ʾΪ�� ��
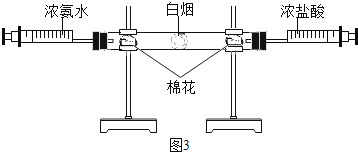
��4������ʯ��ˮ��ʵ���ҳ��õ��Լ�֮һ����ͼ2��ʾ��ͬѧ��������ʵ�飺
�ټ����ܹ۲쵽������������ ��
�����еķ�Ӧ���û�ѧ����ʽ��ʾΪ���� ����
����ͬѧ���ס�������ʵ�����������ȫ�������ʵ�����ձ��л�ϣ���Ĭһ������۲쵽�ϲ���ҺΪ��ɫ���ײ��а�ɫ������ȡ�����ϲ���Һ��������ϡ���ᣬ�����������ۺϷ�����֪�����ϲ���Һ��һ�����е������Ƿ�̪�� �����ܺ��е������� ��
���𰸡�
��1������©����ˮ��
��2��2KClO3![]() 2KCl+3O2����E
2KCl+3O2����E
��3��CaCO3+2HCl=CaCl2+H2O+CO2��
��4�������ʯ��ˮ����� ���������ɫ��������Ca��OH��2+Na2CO3=CaCO3��+2NaOH��NaCl��CaCl2
����������1������©�������Һ��ҩƷ��ˮ����ʢˮ�����������Դ��ǣ�����©����ˮ�ۣ�
��2����������������������Ҫ���ȣ�������ڶ��������������ͼ��ȵ������������Ȼ��غ���������ƽ���ɣ��������ܶȱȿ������ܶȴ�������ˮ��������������ſ���������ˮ���ռ�����ˮ���ռ��������Ƚϴ��������Դ��ǣ�2KClO3![]() 2KCl+3O2����E��
2KCl+3O2����E��
��3��̼��ƺ����ᷴӦ�����Ȼ��ƺ�ˮ�Ͷ�����̼����ƽ���ɣ����Դ��ǣ�CaCO3+2HCl=CaCl2+H2O+CO2����
��4�� �����ܹ۲쵽�����������ǣ������ʯ��ˮ����ǣ��������ɫ���������������ƺ�̼���Ʒ�Ӧ����̼��ư�ɫ�������������ƣ���ƽ���ɣ��ۺϷ�����ʵ���֪�� ���ϲ���Һ��һ�����е������Ƿ�̪��NaCl�����ܺ��е��������Ȼ��ƣ���Ϊȡ�����ϲ���Һ��������ϡ���ᣬ�������������Դ��ǣ��ٳ����ʯ��ˮ����� ���������ɫ����������Ca��OH��2+Na2CO3=CaCO3��+2NaOH����NaCl��CaCl2 ��
�����㾫����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�ǽ����ĸ�������Ҫ֪��ע�⣺a����ƽ b������ c�����ţ�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���ڸ����£�����ˮ�����ܷ�����Ӧ����һ�ֳ��������������һ�����壮ij��ѧѧϰС���ͬѧ�Դ˷�Ӧ�ܸ���Ȥ����С�鼯��Э�������������ʵ�飬��̽��������ˮ������Ӧ��IJ��Ҳ������һ�����������̽����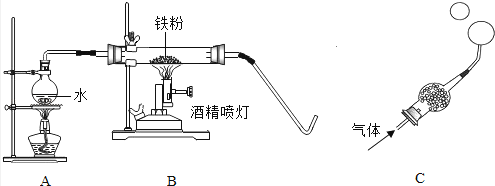
��1��Aװ�õ������� ��
��2��̽�����ɵ�������ʲô��
����������衿����һ�����ɵ��������������������������ɵ����������������
��ʵ��̽���������ɵ�����ͨ��Cװ�ã����ι���װ�м�ʯ�Ҹ���������ܿ�պЩ����ˮ����ϴ�Ӽ���Һ���������������٣����������ݣ��������ݴ���һ����ʱ������ڶ����ܣ�����������ܿں�������������ȼ�ŵ�ľ�����������ݣ��б�������
���ƶϡ����ɵ������� ��
��3��̽���Թ���ʣ�����ɷ���ʲô��
���������ϡ�
�������������� | FeO | Fe2O3 | Fe3O4 |
��ɫ��״̬ | ��ɫ��ĩ | ����ɫ��ĩ | ��ɫ���� |
�ܷ������� | �� | �� | �� |
�ܷ������ᷴӦ | �� | �� | �� |
��������֤���Թ���ʣ�����Ϊ��ɫ����ȫ��������������
����������衿����һ��ʣ�������Fe��Fe3O4���������ʣ������� ��
��ʵ��̽����
ʵ����� | ʵ�������� |
�� | �� |
��ʵ����ۡ�����ˮ������Ӧ�Ļ�ѧ����ʽΪ���� ����
����˼�뽻�����ú�ɫ���岻������FeO��Fe2O3 �� ������ ��