题目内容
【题目】将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
A.28.0g B.44.8g C.56.0g D.78.0g
【答案】A
【解析】100g含CaCO3质量分数为80%的石灰石样品中钙元素的质量分数 = 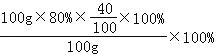 =32%;
=32%;
假设碳酸钙完全分解,设此时反应放出二氧化碳的质量为x,生成氧化钙的质量为y
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 56 44
100g×80% y x
![]() x=35.2g
x=35.2g
![]() =
=![]() y=44.8g
y=44.8g
碳酸钙完全分解后剩余固体中钙元素的质量分数=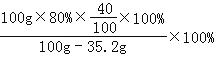 ≈49%
≈49%
即完全分解时钙元素的质量分数为49%,而现在钙元素的质量分数只有41%,说明除了杂质和氧化钙之外还有剩余的碳酸钙,即碳酸钙并未完全分解.在只有部分碳酸钙分解生成氧化钙时,生成氧化钙的质量应小于44.8g选项中只有A为28.0g<44.8g故选:A.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

