题目内容
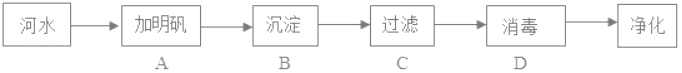
【题目】现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。鉴别它们可按下图所示的步骤进行,回答下列问题

(1)溶液A、B、C中的溶质分别是A_________,B_________,C_________。(填化学式)
(2)用X鉴别D、E时,X可以选用不同的物质。
①若X为稀盐酸,写出有气体生成的反应的化学方程式____________________;
②若X为氯化钙溶液,写出有沉淀生成的反应的化学方程式____________________。
【答案】 H2SO4 CuSO4 NaCl Na2CO3+2HC1=2NaCl+H2O+CO2↑ CaCl2+Na2CO3=CaCO3↓+2NaCl
【解析】硫酸铜在溶液中显蓝色,氢氧化钠、碳酸钠溶液显碱性,能使紫色石蕊试液显蓝色,稀硫酸显酸性,能使紫色石蕊试液显红色,氯化钠溶液显中性,不能使紫色石蕊试液变色,碳酸钠会与酸反应生成二氧化碳气体,会与钙离子、钡离子反应生成白色沉淀;(1)取五种溶液观察颜色,B溶液显蓝色,所以B是硫酸铜,剩余的四种溶液加入紫色石蕊试液,A溶液显红色,所以A是稀硫酸,C溶液显紫色,所以C是氯化钠溶液,D、E溶液显蓝色,所以D、E是氢氧化钠溶液、碳酸钠溶液,经过验证,推导正确;(2)通过推导可知,D、E是碳酸钠、氢氧化钠,所以①若X为稀盐酸,盐酸与碳酸钠反应生成生成氯化钠、二氧化碳和水,反应的化学方程式:Na2CO3+2HC1=2NaCl+H2O+CO2↑;②若X为氯化钙溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl。

【题目】甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是
A.表中a的值为2.6 B.X一定是该反应的催化剂
C.X可能含有氢元素 D.X一定含有氧元素
【题目】请根据下列实验装置图,回答有关问题。
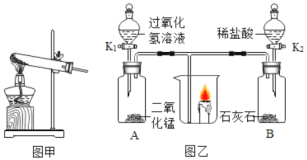
(1)图甲是实验室加热高锰酸钾制取氧气的发生装置,实验时应在试管口塞一团棉花,其作用是_____。试管中发生反应的符号表达式为_____,属于_____反应(反应类型)。
(2)图乙中标号仪器①的名称_____。
利用图乙进行下列实验:
I:开始先关闭K2,打开K1,片刻后观察到烧杯中蜡烛燃烧更剧烈,A中发生反应的符号表达式为_____,其中二氧化锰的作用是_____。
Ⅱ:然后关闭K1,打开K2,观察到烧杯中蜡烛燃烧不旺直至熄灭,B中发生反应的符号表达式为_____,蜡烛逐渐熄灭说明二氧化碳具有的化学性质是_____。
气体 | 药品 | 条件 |
①氢气 | 锌粒和稀硫酸 | 常温 |
②氯气 | 二氧化锰和浓盐酸 | 加热 |
③硫化氢 | 硫化亚铁固体和稀硫酸 | 常温 |
(3)下列三种气体能选用图乙中A作为发生装置的是_____(填序号)。