题目内容
【题目】实验室有氧化铜和铁的混合物粉末,为提炼其中的铜,现进行如下操作: 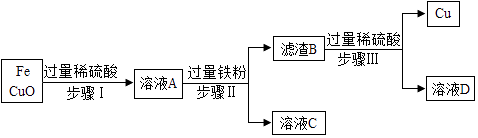
(1)步骤Ⅱ所需用到的仪器有铁架台、烧杯、(请再写出两种玻璃仪器).
(2)溶液C中的溶质是 . (填化学名称)
(3)现有20g溶质质量分数为98%的浓硫酸,要将其稀释成质量分数为9.8%的稀硫酸,需加水多少毫升?(写出计算过程)
【答案】
(1)玻璃棒和漏斗
(2)FeSO4
(3)解:设9.8%的稀硫酸的质量x,
根据题意有:20g×98%=x×9.8%,
x=200g
加入的水的质量为200g﹣20g=180g折合180mL
答:需加水180mL.
【解析】解:(1)步骤Ⅱ所需用到的仪器有铁架台、烧杯、玻璃棒和漏斗. 故填:.(2)溶液A中含有硫酸亚铁、硫酸铜和硫酸,加入足量铁时,铁和稀硫酸反应生成硫酸亚铁和氢气,和硫酸铜反应生成硫酸亚铁和铜,因此溶液C中的溶质是
FeSO4 .
故填:FeSO4 .
【考点精析】通过灵活运用过滤操作的注意事项和金属材料的选择依据,掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属即可以解答此题.

练习册系列答案
相关题目