题目内容
(8分)在学习了金属的化学性质后,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
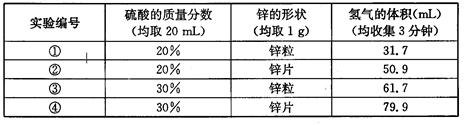
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
(1)写出稀硫酸与锌反应的化学方程式______________。
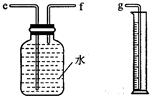
(2)小兵用下图装置收集并测量氢气的体积,其中量筒的作用是__________________,氢气应从_______(填e或f或g)管通入。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的
实验编号是_______,
【得出结论】
(4)结论是________________________________________________________。
【评价与反思】
(5)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。
______________________________________________________________________。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。

(1)写出稀硫酸与锌反应的化学方程式______________。
(2)小兵用下图装置收集并测量氢气的体积,其中量筒的作用是__________________,氢气应从_______(填e或f或g)管通入。

【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的
实验编号是_______,
【得出结论】
(4)结论是________________________________________________________。
【评价与反思】
(5)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。
______________________________________________________________________。
(1) Zn + H2SO4 ="==" ZnSO4 + H2↑ (2) 根据进入量筒内水的体积,判断生成氢气的体积 f
(3) ①③或②④
(4)硫酸的质量分数越大,反应速率越快,锌与硫酸的接触面积越大,反应速率越快
(5)温度,取质量相等的锌粒,放入两只试管中,然后分别加入温度不用,体积和溶质质量分数相等的稀硫酸,测量收集等体积氢气所需的时间
(3) ①③或②④
(4)硫酸的质量分数越大,反应速率越快,锌与硫酸的接触面积越大,反应速率越快
(5)温度,取质量相等的锌粒,放入两只试管中,然后分别加入温度不用,体积和溶质质量分数相等的稀硫酸,测量收集等体积氢气所需的时间
试题分析:(1) 稀硫酸与锌反应的化学方程式:Zn + H2SO4 ="==" ZnSO4 + H2↑
(2) 要测量氢气的体积,其中量筒的作用:根据进入量筒内水的体积,判断生成氢气的体积,因为要将水排出到量筒内,所以氢气应从f管通入
(3) 比较不同质量分数的硫酸对反应快慢的影响,应注意控制变量,即只要保证硫酸的质量分数不同,其它的条件不变,应选择的实验编号是①③或②④
(4)根据表中数据①③或②④对比,收集相等体积的氢气,所需使用的时间与硫酸的质量分数成反比,而根据表中数据①②或③④对比,锌粒比锌片反应的速率更快,所以结论是:硫酸的质量分数越大,反应速率越快,锌与硫酸的接触面积越大,反应速率越快
(5)锌与硫酸反应的快慢可能还受温度、酸的种类等因素的影响,探究温度的影响:取质量相等的锌粒,放入两只试管中,然后分别加入温度不用,体积和溶质质量分数相等的稀硫酸,测量收集等体积氢气所需的时间

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目