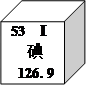
题目内容
将10gM的蒸气与9.6gN气体混合于密闭容器中,点燃,充分反应后所得物质中含有3.6gM和8.8gP,还有一定量的Q。若已知M、N、P、Q的相对分子质量依次为32、32、44、18,则该密闭容器中发生反应的化学方程式为( )
A.M+2N 2P+Q 2P+Q | B.M+2N P+2Q P+2Q |
C.2M+3N 2P+3Q 2P+3Q | D.2M+3N 2P+4Q 2P+4Q |
(2分)D
解:根据题意可以知道反应中消耗的M的质量为:10g-3.6g=6.4g;消耗N的质量为:9.6g,生成了P的质量为:8.8g,所以根据质量守恒定律可以知道生成了Q的质量为:6.4g+9.6g-8.8g=7.2g;
在此反应中M、N为反应物,而P、Q为生成物.
根据化学方程式的意义可以知道据物质实际质量的比为各相对分子质量总和的比,所以设M的化学计量数为a,N的化学计量数为b,所以可以知道:32a:32b=6.4g:9.6g,所以a:b=3:2,同理设P的化学计量数为c,Q的化学计量数为d,则:44c:18d=8.8g:7.2g,c:d=2:3,
故可判断反应的化学方程式为2M+3N 2P+3Q;分析题给的选项可知选项D为正确的选项.
2P+3Q;分析题给的选项可知选项D为正确的选项.
故选D.
在此反应中M、N为反应物,而P、Q为生成物.
根据化学方程式的意义可以知道据物质实际质量的比为各相对分子质量总和的比,所以设M的化学计量数为a,N的化学计量数为b,所以可以知道:32a:32b=6.4g:9.6g,所以a:b=3:2,同理设P的化学计量数为c,Q的化学计量数为d,则:44c:18d=8.8g:7.2g,c:d=2:3,
故可判断反应的化学方程式为2M+3N
 2P+3Q;分析题给的选项可知选项D为正确的选项.
2P+3Q;分析题给的选项可知选项D为正确的选项.故选D.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目