题目内容
(1)质量相等、溶质的质量分数也相同的稀盐酸和稀硫酸,分别与足量的金属镁反应,
(2)等质量的锌和铁分别与足量的、质量相等的、溶质的质量分数也相同的稀盐酸反应,锌、铁全部溶解.金属
稀盐酸
稀盐酸
反应产生的气体多.(2)等质量的锌和铁分别与足量的、质量相等的、溶质的质量分数也相同的稀盐酸反应,锌、铁全部溶解.金属
铁
铁
反应产生的气体多;投入金属锌
锌
的稀盐酸中,HCl一定有剩余.分析:(1)质量相等、溶质的质量分数也相同的稀盐酸和稀硫酸中溶质质量相等和根据稀盐酸和镁反应生成氯化镁和氢气、稀硫酸和镁反应硫酸镁和氢气的化学方程式计算.
(2)等质量的锌和铁分别与足量的、质量相等的、溶质的质量分数也相同的稀盐酸反应,锌、铁全部溶解,根据生成氢气的质量=
,来考虑本题.
(2)等质量的锌和铁分别与足量的、质量相等的、溶质的质量分数也相同的稀盐酸反应,锌、铁全部溶解,根据生成氢气的质量=
| 金属的化合价 |
| 金属的相对原子质量 |
解答:解:(1)解:设两种酸中溶质的质量都为ag,镁和稀盐酸反应生成的氢气的质量为x,镁和稀硫酸反应生成的氢气的质量为y.
Mg+2HCl=MgCl2+H2↑
71 2
ag x
=
,则解得x=
g
Mg+H2SO4=MgSO4+H2↑
98 2
ag y
=
,则解得y=
g,可见x>y,所以稀盐酸生成的氢气质量大.
(2)根据生成氢气的质量=
,等质量的锌和铁分别与足量的、质量相等的、溶质的质量分数也相同的稀盐酸反应,锌、铁全部溶解.则金属 铁反应产生的气体多;投入金属 锌的稀盐酸中,HCl一定有剩余.
故答案为:(1)稀盐酸; (2)铁;锌
Mg+2HCl=MgCl2+H2↑
71 2
ag x
| 71 |
| ag |
| 2 |
| x |
| 2a |
| 71 |
Mg+H2SO4=MgSO4+H2↑
98 2
ag y
| 98 |
| ag |
| 2 |
| y |
| 2a |
| 98 |
(2)根据生成氢气的质量=
| 金属的化合价 |
| 金属的相对原子质量 |
故答案为:(1)稀盐酸; (2)铁;锌
点评:本题考查了根据稀盐酸和稀硫酸与金属反应的化学方程式的计算,要抓住金属足量,盐酸和稀硫酸中溶质质量相等计算产生氢气的质量然后比较即可.也可根据化学反应前后元素质量守恒,根据氯化氢和硫酸的化学式计算氢元素的质量分数即可比较.

练习册系列答案
相关题目
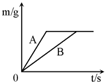 金属材料用途广泛,回答下列问题:
金属材料用途广泛,回答下列问题: (2012?淮安)将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题.
(2012?淮安)将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题.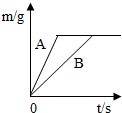 (2013?呼和浩特)金属与我们的生活息息相关,在各个领域中用途广泛.
(2013?呼和浩特)金属与我们的生活息息相关,在各个领域中用途广泛.